L’activation du récepteur aux cannabinoïdes de type 2 favorise la production de spermatozoïdes in vitro
Dr. Ludovic Dumont1 (Ingénieur de Recherche) et la classe de 1ère – Terminale du lycée Groupe Scolaire Sévigné de Mme Joséphine Villain Sawadogo2 (la liste des élèves est mentionnée en fin d’article)
Article original/Original article : Dumont L, Rives-Feraille A, Delessard M, et al. Activation of the cannabinoid receptor type 2 by the agonist JWH133 promotes the first wave of in vitro spermatogenesis. Andrology. 2021 Mar;9(2):673-688.
Institutions : 1Université de Rouen, Inserm U1239 – Différenciation et Communication Neuroendocrine Endocrine et Germinale (NorDiC), 25 Rue Lucien Tesnière, 76130 Mont-Saint-Aignan
2Groupe Scolaire Sévigné, 20 rue de la Sous-Préfecture 60200 Compiègne
Résumé :
Cet article a été écrit par 13 élèves de l’Institution Sévigné de Compiègne avec leur professeur de SVT à partir d’une étude menée par l’équipe où travaille le Docteur Dumont et avec sa collaboration. Ils se sont intéressés à un article qui démontre que l’activation du récepteur aux cannabinoïdes de type 2 favorise la production de spermatozoïdes in vitro. Grâce à cette réécriture, les élèves ont pu apprendre le rôle majeur des endocannabinoïdes et du récepteur de cannabinoïdes de type 2 dans le développement des cellules germinales pendant la première vague de la spermatogenèse chez la souris.
Mots clés : récepteur aux cannabinoïdes ; spermatogénèse ; spermatozoïdes ; culture organotypique ; ploïdie
I. État de l’Art et Introduction
Le taux de survie après un cancer chez l’enfant a augmenté grâce aux progrès remarquables réalisés dans le diagnostic et le traitement du cancer. Malheureusement, les traitements de cancers du jeune garçon ont des effets secondaires indésirables irréversibles sur les cellules souches spermatogoniales (CSS) du testicule, entraînant une infertilité à l’âge adulte. C’est pourquoi avant d’entamer un traitement pouvant être néfaste et provoquant l’infertilité du jeune garçon, il lui est proposé une conservation par congélation de son tissu testiculaire. A partir de cellules souches spermatogoniales, une des stratégies potentielles de restauration de la fertilité est de produire des spermatozoïdes in vivo (au sein du vivant) ou in vitro (sous verre). Cette technique reste de l’ordre de la recherche et ne fonctionne pas encore actuellement sur du tissu humain. La spermatogénèse (Figures 1 et 2) in vitro a été réalisée en laboratoire chez la souris avec la technique de culture organotypique (toute ou partie d’un organe) et permet un avantage (i) par sa durée de culture qui assure la production de spermatozoïdes in vitro à partir de CSSs et (ii) car elle contient toutes les cellules germinales et somatiques dans leur configuration physiologique.
De façon plus explicite, des enfants atteints de cancer vont subir des traitements qui seront néfastes pour leurs testicules (gonadotoxicité). Afin de préserver leur fertilité, les chercheurs congèlent un bout de leur testicule (composé de cellules souches uniquement car ces enfants ne sont pas encore pubères et ne possèdent pas encore de spermatozoïdes). Lorsque ces enfants seront devenus adultes et qu’ils auront un projet parental, une des solutions envisageables pour leur permettre d’enfanter est de transformer leurs cellules souches en spermatozoïdes pour ensuite effectuer une fécondation in vitro (FIV). Au laboratoire, l’équipe de recherche a travaillé depuis plus de 10 ans sur la congélation (qui fonctionne maintenant très bien, même chez l’humain). Cependant, la production de spermatozoïdes à partir de cellules souches chez l’humain n’est pas encore applicable et le rendement chez la souris reste encore faible.
Des recherches effectuées en laboratoire chez la souris (Figure 3) ont mis en évidence la possibilité de générer in vitro une spermatogenèse complète et fonctionnelle (avec l’obtention d’une descendance) à partir de tissus de souriceaux prépubères (6 jours) après 30 jours de culture (Sato et al., 2010). Cependant, le rendement en spermatozoïdes produits in vitro reste faible (Dumont et al., 2015). Des données plus récentes ont montré que la progression méiotique et post-méiotique pourrait être altérée (Dumont et al., 2016).
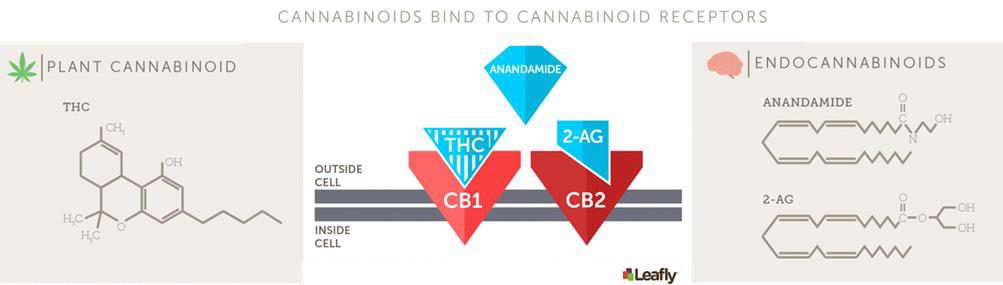
Il existe des lipides naturels, les cannabinoïdes endogènes (ou endocannabinoïdes), qui servent de modulateurs de la spermatogenèse (Grimaldi et al., 2013) et de la reproduction (Du Plessis et al., 2015). Ces endocannabinoïdes sont capables de se lier et d’activer les récepteurs aux cannabinoïdes de type 1 (CB1) au niveau du cerveau et de type 2 (CB2) au niveau du testicule (Li et al., 2018) (Figures 4 et 5) qui miment certains effets du Δ9-tétrahydrocannabinol (THC), le composant psychoactif du Cannabis sativa (Sugiura et al., 2002).
Les cellules germinales mâles mitotiques (spermatogonies) et méiotiques (spermatocytes) possèdent un système endocannabinoïde complet et actif qui est modulé au cours de la spermatogenèse. Il a été proposé que le CB2 joue un rôle important dans l’entrée en méiose des cellules germinales mâles postnatales (Grimaldi et al., 2009). Un composé chimique (le JWH133) mimant l’action d’endocannabinoïdes a donc été ajouté pour activer les récepteurs CB2 afin d’augmenter l’entrée en différenciation des cellules ‘souches’ durant la première phase de la spermatogenèse in vitro chez la souris. Le but de cette étude n’est donc pas d’évaluer la toxicité introduite par la toxine THC mais de se focaliser sur les actions bénéfiques de l’activation du récepteur CB2 au sur les cellules germinales.
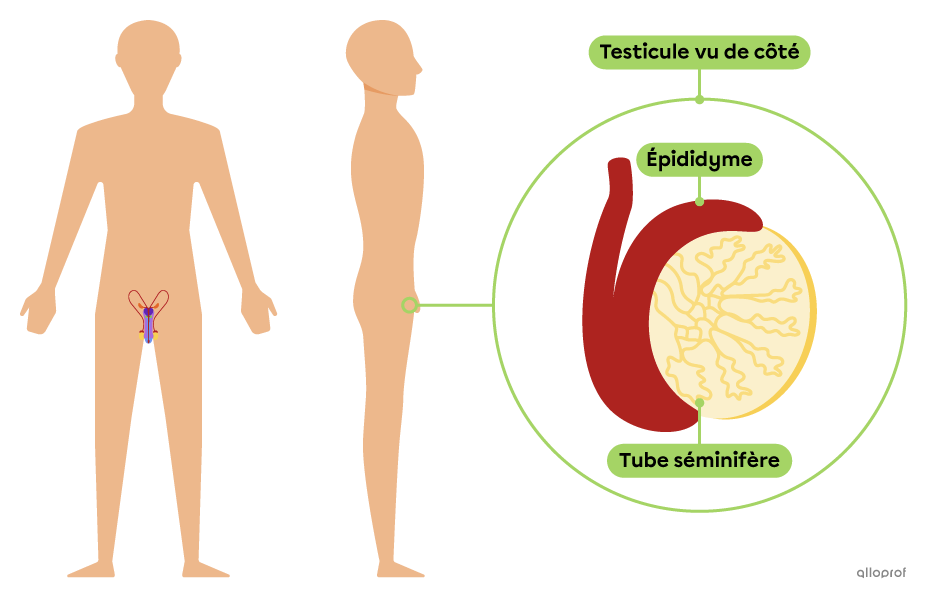
Figure 1 : Origine de la spermatogenèse. Les gamètes mâles, les spermatozoïdes, sont produits dans les tubes séminifères des testicules qui sont situés dans la gonade mâle : le testicule. Référence : https://www.alloprof.qc.ca/fr/eleves/bv/sciences/la-spermatogenese-s1301
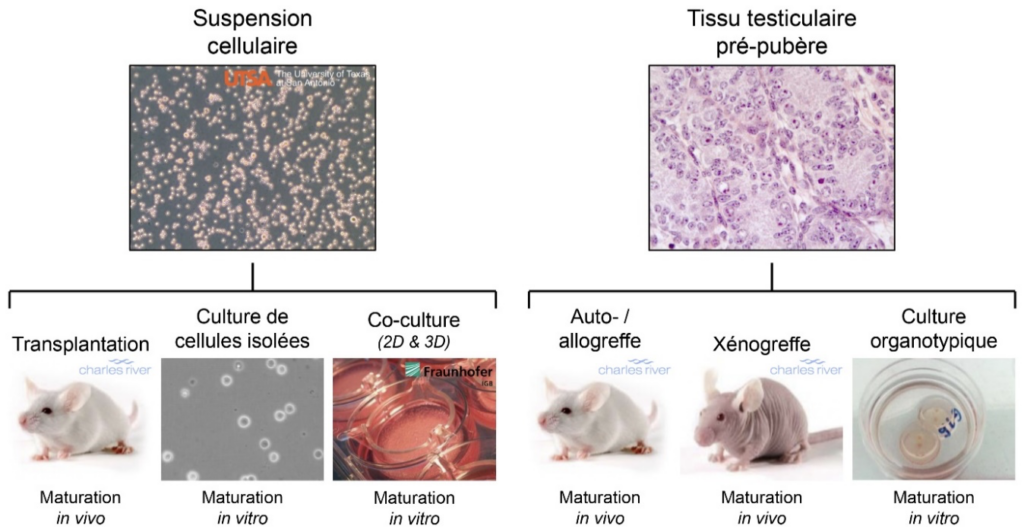
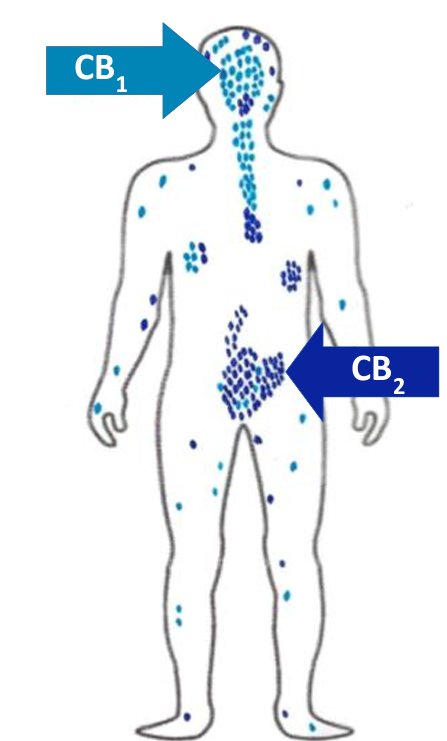
Figure 4 : Schéma illustrant la présence et la concentration des récepteurs CB1 et CB2 dans le corps humain, majorité du CB2 au niveau testiculaire. Les récepteurs CB1, sont des récepteurs couplés aux protéines G (familles de protéines à sept domaines transmembranaires). On les trouve en quantités très élevées dans le système nerveux (central et périphérique). Les récepteurs CB2 se localisent au niveau des différentes parties du système immunitaire, le foie, le placenta et le système nerveux ainsi que dans les organes reproducteurs mâles (testicules). Référence : https://www.norml.fr/sante-prevention-rdr/le-systeme-endocannabinoides/
II. Matériels et Méthodes
1. Approbation éthique
Le comité de protection et d’utilisation d’animaux de l’Université de Rouen a approuvé toutes les procédures expérimentales réalisées dans cette étude, selon la règle des 3R (Remplacer l’expérimentation animale si possible, et à défaut, Réduire le nombre d’animaux utilisés et Raffiner les procédures).
2. Culture in vitro et contrôles in vivo
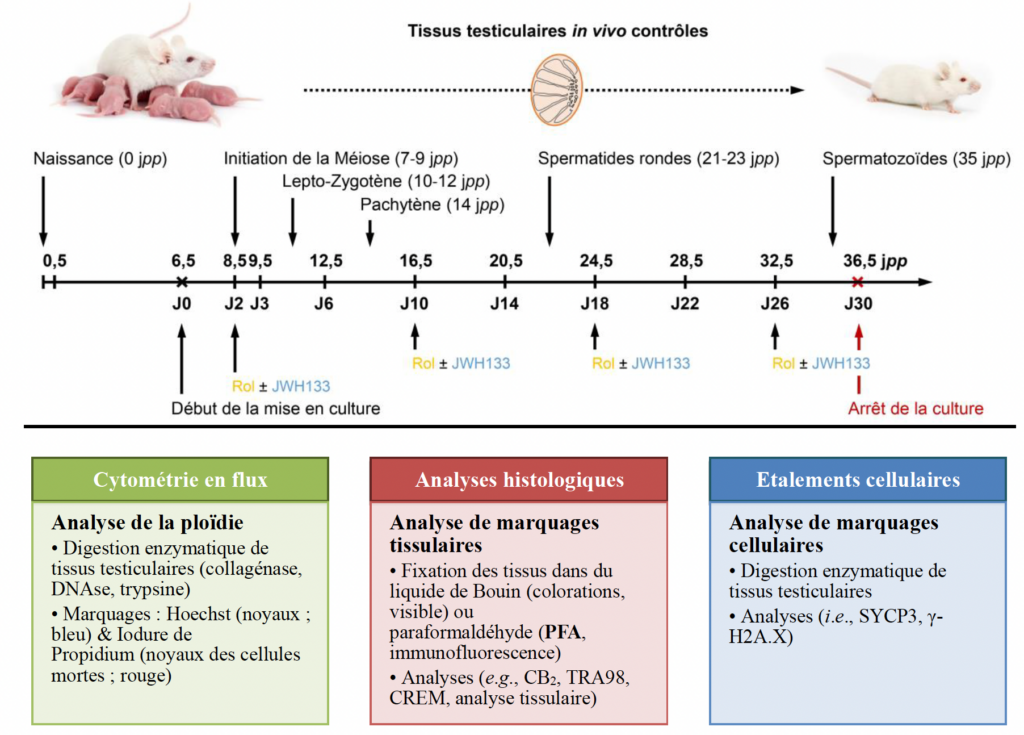
Afin d’évaluer l’impact de l’activation de CB2 au cours de la première vague de la spermatogenèse, des cultures in vitro sont effectuées à partir de tissus testiculaires prépubères. Les contrôles in vivo (témoins) ont été faits (Figure 6) en utilisant des testicules de souris (aux âges correspondants aux étapes de la spermatogénèse). En se référant aux différents stades de la spermatogénèse, des temps ont été sélectionnés car des stades spécifiques des cellules germinales étaient présents.
3. Analyses morphologiques
De fines sections de tissus testiculaires et d’explants ont été montées sur des lame de Polysine et ont été colorées (i) avec l’hématoxyline éosine safran (HES) pour l’appréciation de la morphologie testiculaire et (ii) avec la réaction de Periodic acid-Schiff (PAS) pour la détection de l’acrosome, caractéristique des spermatides rondes.
4. Immunomarquages
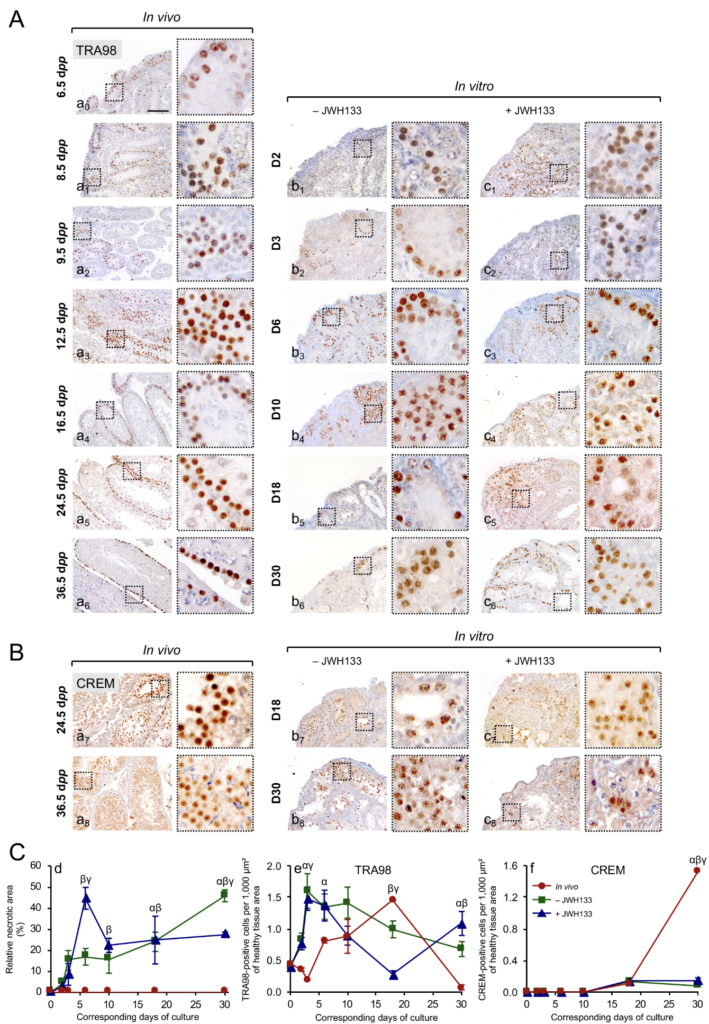
L’immunofluorescence et l’immunohistochimie (Figure 7, Tableau 1) sont basés sur une réaction antigène-anticorps. Ces méthodes sont employées afin de détecter des antigènes ou des anticorps. Quand on souhaite repérer des antigènes, il est nécessaire d’avoir des anticorps spécifiques correspondant à la spécificité antigénique recherchée. Il s’agit de sérums polyclonaux préparés chez l’animal, d’immunoglobulines purifiées ou, plus souvent, d’anticorps monoclonaux. Dans cette étude, suite à la fixation d’un anticorps sur l’antigène d’intérêt, il a été possible de le visualiser avec le chromogène le 3,3’-Diaminobenzidine (DAB) formant une coloration marron.
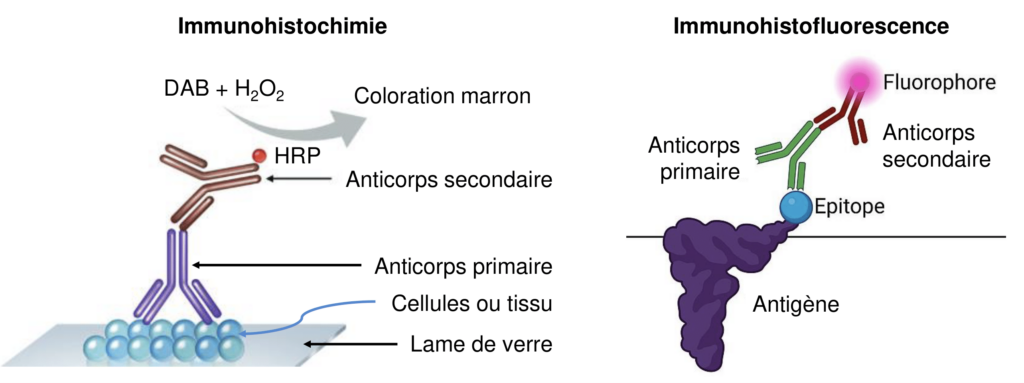
| Immunohistochimie | Immunofluorescence | ||
| Anticorps utilisés | Anticorps de rat | Anticorps de lapin | Anticorps de lapin |
| Anti-TRA98 | Anti-CREM | Anti- CB2 | |
| Identification | Spermatogonie, Spermatocytes I Leptotène, Zygotène, Pachytène (stade précoce) | Spermatocyte Pachytène (stade tardif), Spermatide ronde | Présence de CB2 |
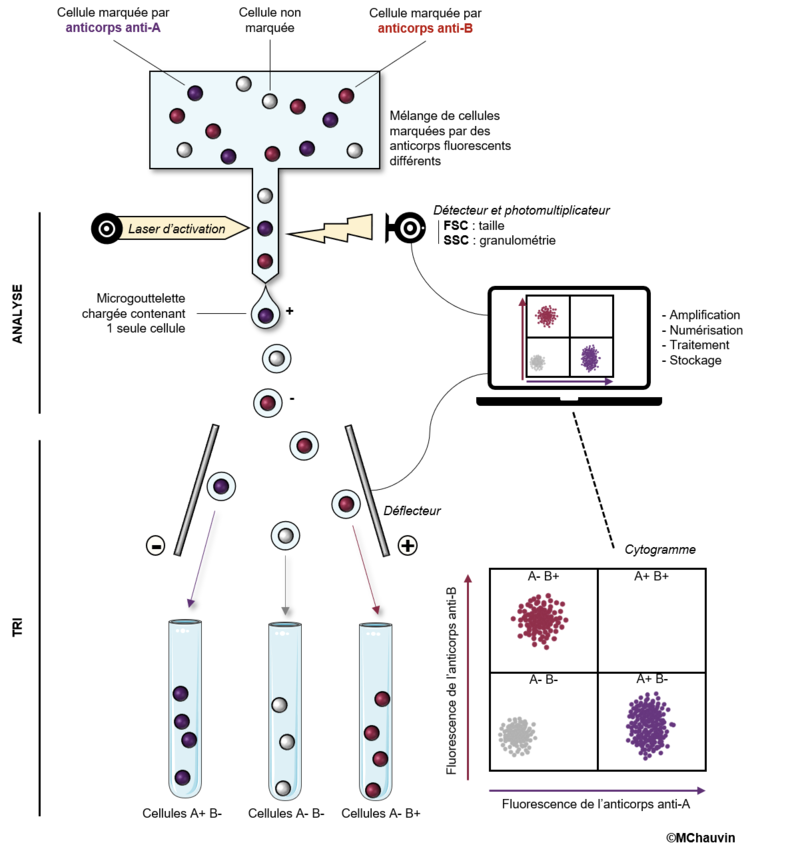
5. Cytométrie en flux.
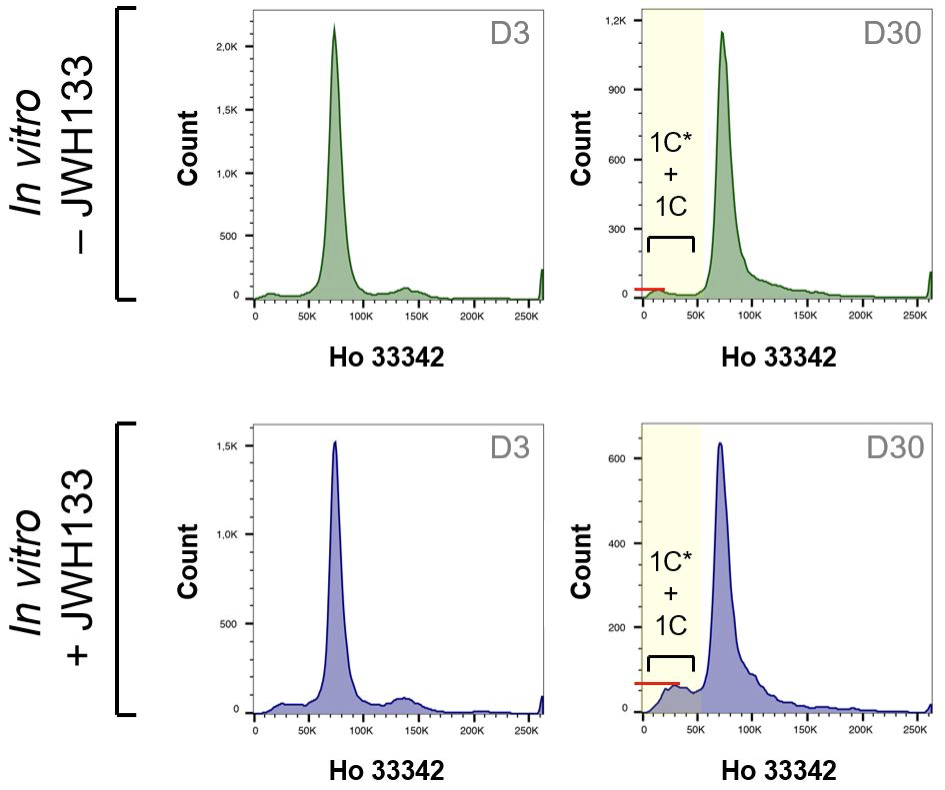
La technique de cytométrie en flux (Figure 8) permet une évaluation de la ploïdie des cellules en évaluant la quantité d’ADN dans chaque noyau : 4C : différents stades de spermatocyte I et spermatogonies G2 ; 2C : spermatogonies G1 et spermatocyte II ; 1C : spermatide allongée et spermatide ronde et 1C* : spermatozoïde et spermatide allongé.
6. Évaluation de l’étalement des cellules testiculaires.
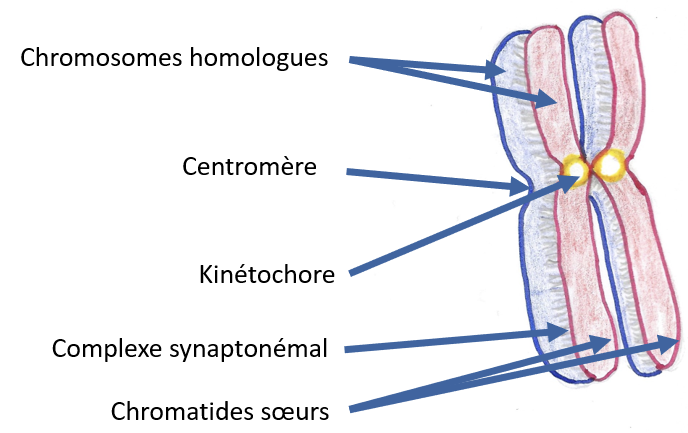
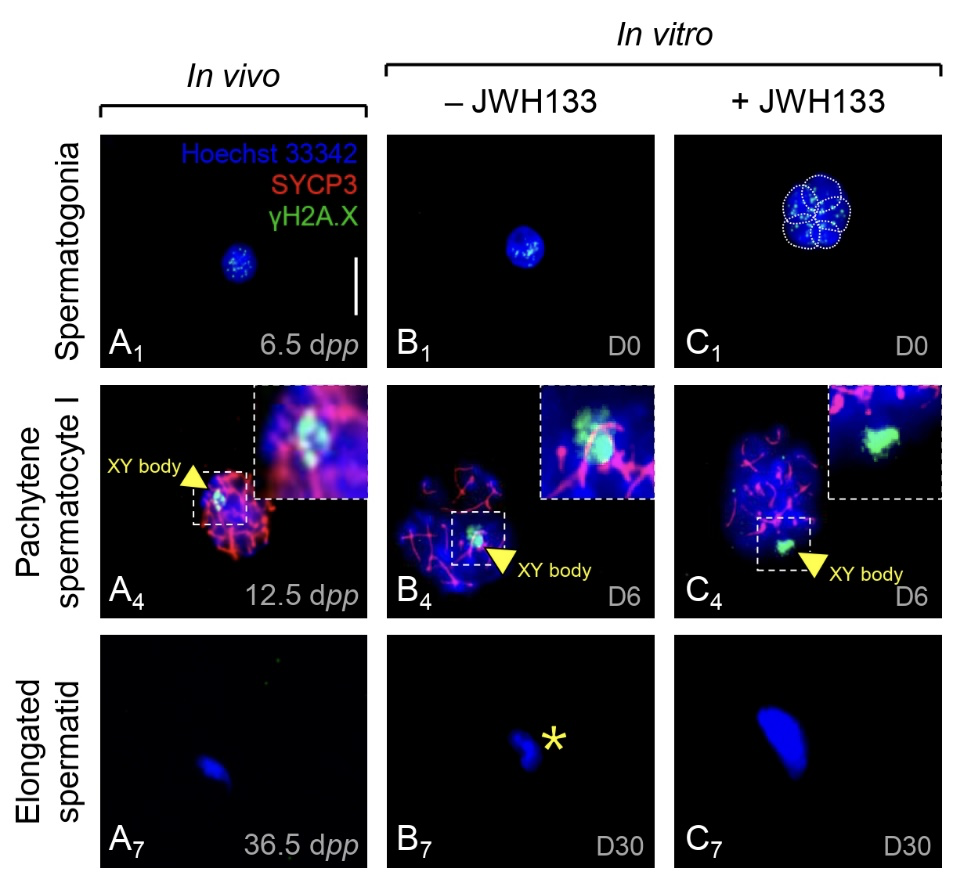
Un marquage de la protéine 3 du complexe synaptonémal (SYCP3) (Figure 9) a été effectué afin d’identifier les éléments axiaux chromosomiques présents à la prophase I de la méiose. De même pour détecter les régions chromosomiques non synaptiques, le marquage de l’histone H2A.X phosphorylée (γ-H2A.X) a été effectué. L’ADN contenu dans le noyau des cellules a été marqué avec au DAPI.
III. Résultats et Discussion
1. Une concentration de 1 µM de JWH133 permet une meilleure différenciation in vitro des cellules germinales testiculaires prépubertaires
Une première série de cultures d’explants testiculaires de souris de 6,5 jours post-partum (jpp) a été réalisée afin d’évaluer l’impact d’une gamme de supplémentation en JWH133 (10 nM, 100 nM, 1 µM, 10 µM). La concentration de 1 μM de JWH133 a été trouvée comme étant celle qui réduit la zone nécrotique centrale à 30 jours (J30) et favorise un nombre plus élevé de cellules CREM-positives par zone de tissu sain. Ces données sont cohérentes avec d’autres études de la littérature scientifique qui ont évalué l’impact de JWH133 sur la culture de cellules isolées avec une concentration optimale de 1 μM.
2. CB2 est exprimé dans les tissus testiculaires cultivés in vitro pendant l’initiation de la méiose de la première vague de la spermatogenèse
CB2 est exprimé au niveau de la membrane plasmique des cellules intratubulaires dans un nombre réduit de tubes séminifères à 6,5 jpp (Figure 10 A1-C1). Les tubes séminifères avec une forte expression de CB2 apparaissent à J3 (Figure 10 A3-C3). Le pourcentage de tubes séminifères avec une expression de CB2 est plus élevé à J3 (13,8 ± 1,28%) après 24 h de supplémentation avec JWH133 initiée à J2, confirmant une expression de CB2 in vitro. Ces résultats sont en accord avec les observations faites par une autre équipe sur des cultures de cellules murines isolées obtenues à partir de tissus testiculaires de souris de 6,5 jpp et cultivées pendant 24 h.
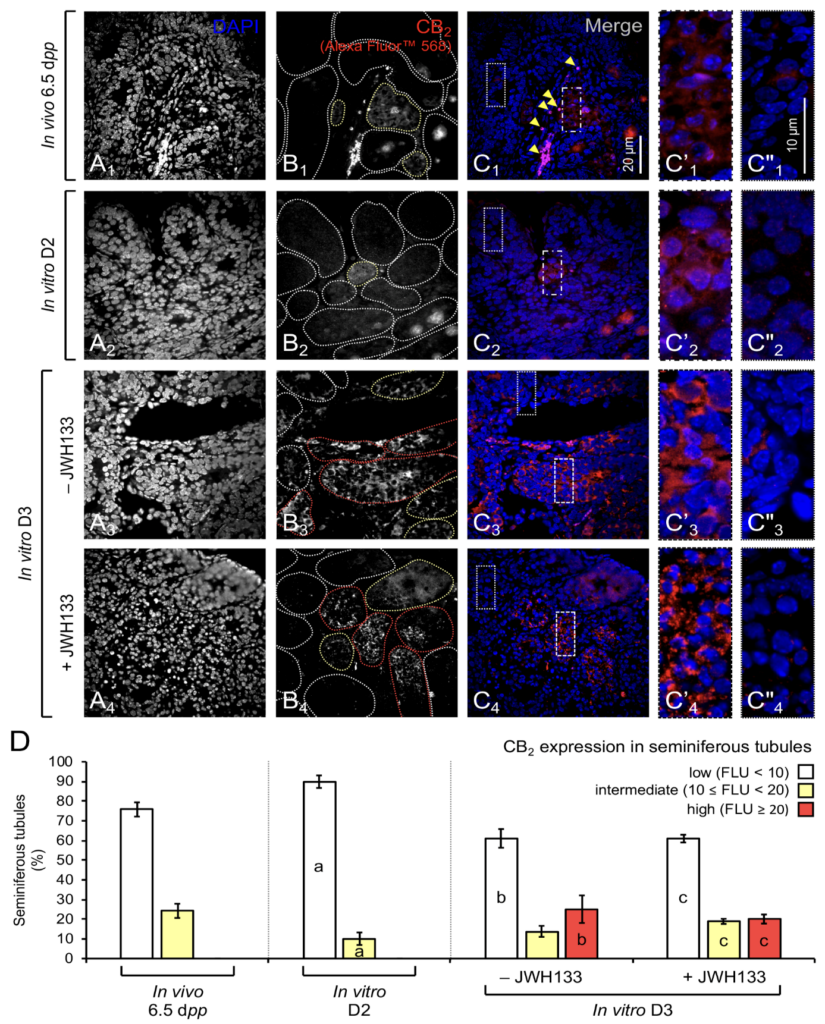
3. La ploïdie des cellules issues du tissu testiculaire est modifiée in vitro par la supplémentation en JWH133.
On peut observer une discrète entrée en méiose des spermatogonies pour les explants testiculaires cultivés in vitro. A la fin de la culture à J30, la proportion de cellules évaluées comme étant des cellules haploïdes post-méiotiques (représentant 1C* + 1C) obtenues après une supplémentation avec JWH133 (12,2 ± 1,61%) est plus élevée que sans supplémentation (6,30 ± 1,16%, P = 0,0286) (Figure 11).
4. La supplémentation en JWH133 permet une meilleure différenciation des cellules germinales testiculaires de testicules prépubères cultivés in vitro.
Le développement progressif des cellules germinales à des moments clefs de la spermatogenèse (Figure 12) a été évalué tout au long de (i) la culture in vitro (jour 2 [D2], J3, J6, J10, J18, et J30) couplée à (ii) des contrôles in vivo (8, 9, 12, 16, 25, et 36 jpp). Aucune formation de nécrose n’a été observée pour les tissus testiculaires témoins in vivo. Pour les cultures in vitro, une importante zone nécrotique a été détectée après environ une semaine de culture. Vers la fin de la culture, une réduction de la zone nécrotique est observée pour la condition utilisant une supplémentation de 1 μM de JWH133 (27,5 ± 1,07%) par rapport aux explants cultivés sans supplémentation (45,8 ± 2,83 %, P = 0,0043). De plus, lorsque l’ajout de JWH133 permet une augmentation du nombre de cellules CREM-positives (cellules germinales post-méiotiques).
5. La culture organotypique maintient la progression de la méiose des cellules germinales.
En culture in vivo, l’entrée en méiose est corrélée à l’expression de la protéine SYCP3 du complexe synaptonémal qui est localisée le long de la chromatine condensée du spermatocyte I zygotène au pachytène. La protéine γ-H2A.X, présente dans les cassures doubles brins de l’ADN, est légèrement visible des spermatogonies au spermatocyte I pachytène au niveau de la vésicule sexuelle (corps XY) (Figure 13). Une spermatogenèse complète a été obtenue in vitro, avec une augmentation du pourcentage de spermatocyte zygotènes après activation de CB2 par 1 μM de JWH133.
IV. Conclusion
Après 30 jours de culture in vitro en interface gaz-liquide :
i. un enrichissement des cellules germinales haploïdes a été détecté par cytométrie en flux ;
ii. une réduction de la zone nécrotique (engendrée par une hypoxie au centre de l’explant testiculaire) a été observée ;
iii. une augmentation de la densité des cellules germinales post-méiotiques a été observée.
Cette étude montre une spermatogénèse complète in vitro observée après 30 jours de culture organotypique d’explants tissulaires de souris prépubères. Cette étude définit le rôle majeur des endocannabinoïdes et du récepteur de cannabinoïdes de type 2 pour le développement des cellules germinales pendant la première vague spermatogène chez la souris. La pertinence clinique potentielle de ces observations est que l’administration d’agonistes à base de cannabinoïdes pourrait stimuler la spermatogenèse in vitro.
Il a été montré que l’activation de CB2 améliore in vitro l’entrée en méiose et la différenciation des spermatogonies, mimant ainsi la transition méiotique physiologique.
| LEXIQUE : Agoniste : Il s’agit d’une molécule qui se lie à un récepteur membranaire et l’active. Il imite souvent le messager naturel qui se lie habituellement au récepteur. Anticorps : Protéine de défense produite par l’organisme en présence d’un antigène dont elle neutralise l’effet toxique. L’anticorps sera spécifique à un antigène donné pour lequel il reconnaîtra une partie spécifique appelée épitope ou déterminant antigénique. Cette spécificité antigène-anticorps est utilisée dans les techniques d’immunomarquage. Apoptose : Processus physiologique de mort cellulaire programmée. Cellules CREM-positives : Marquage spécifique obtenu à partir d’un anticorps détectant spécifiquement la protéine CREM : permet de faciliter la détection des cellules germinales post-méiotiques. Culture in vitro / Culture in vivo : Le terme « in vivo » fait référence à une expérience qui utilise un organisme vivant entier, plutôt qu’un organisme mort. Les essais cliniques et l’expérimentation animale sont deux types de recherche. Les tests in vivo ont été privilégiés par rapport aux tests in vitro car ils sont mieux adaptés à l’observation des effets globaux quand il s’agit d’une expérience sur un sujet vivant. In vitro (du latin « sous verre ») : en milieu artificiel, en laboratoire. Culture organotypique : C’est une méthode consistant à prélever un organe sur un organisme et à le cultiver tout en préservant la structure de l’organe et la plupart des interactions cellulaires. Cytométrie : La mesure caractéristique des cellules. Explant : Fragment de tissu mis en culture. Fixation : Étape en histologie destinée à immobiliser les structures cellulaires et tissulaires, de façon à les représenter le plus vivant possible. Gonadotoxicité : L’effet néfaste d’un traitement anticancer sur la fertilité est appelé “gonadotoxicité”. Cette appellation est issue de la fusion des mots « gonade » (organes de reproduction) et « toxicité » (nocivité). Hoechst 33342 : Marqueur fluorescent utilisé pour marquer l’ADN. Jour post-partum (latin) (jpp) : Jour après l’accouchement. Équivalent en anglais day post-partum (dpp). Leptotène : Se dit du premier stade de la prophase (méiose I), où les chromosomes se présentent sous la forme de longs filaments grêles. Pachytène : Troisième stade de la prophase de la première mitose réductionnelle, caractérisé par le raccourcissement et l’épaississement des chromosomes. Paraformaldéhyde : Forme polymérique solide amorphe blanche de forme formaldéhyde. Le paraformaldéhyde est dépolymérisé en formaldéhyde. Celui-ci peut être utilisé en dentisterie comme fumigant, dans le domaine agricole comme fongicide, bactéricide et en culture cellulaire comme fixateur (ce qui est le cas dans cet article : il va servir à fixer les tissus pour éviter qu’ils ne pourrissent). Ploïdie : Nombre de garnitures chromosomiques simples d’une cellule ou d’un individu, exprimé par le symbole C (comme dans cette article) ou N. Prolifération : Fait proliférer (se multiplier en se reproduisant). Solution de Bouin : Le liquide de Bouin est composé d’acide picrique, de formaldéhyde et d’acide acétique. Le liquide de Bouin sert à fixer des tissus. Spermatide : Cellule sexuelle mâle dont dérive le spermatozoïde. Spermatocyte : Cellule germinale mâle qui devient une spermatide, puis un spermatozoïde. Spermatogenèse : La spermatogenèse est le processus lors duquel un gamète mâle (spermatozoïde) est produit. Un gamète mâle passe par plusieurs stades de développement : la spermatogonie, le spermatocyte de premier ordre, le spermatocyte de deuxième ordre, la spermatide et, pour finir, le spermatozoïde. On part donc d’une spermatogonie diploïde, contenant l’information génétique en entier, pour obtenir 4 spermatozoïdes haploïdes. Spermatogonies : Cellules germinales directement en contact avec la membrane basale du tube séminifère qui donnent naissance à des spermatocytes par des mitoses. Spermiogénèse : Processus de différenciation progressive des spermatides en spermatozoïdes. Tissu sain : Un tissu est un regroupement de nombreuses cellules qui possèdent toutes les mêmes caractéristiques. Ensemble, elles assurent une fonction au sein de l’organe auquel elles appartiennent. Zone nécrotique : C’est une zone au niveau de laquelle, on distingue une mort accidentelle, pathologique des cellules appelée nécrose suite à une agression (une anoxie tissulaire par exemple). Zygotène : Deuxième stade de la prophase de la méiose I, marqué par l’appariement côte à côte des chromosomes homologues sur toute leur longueur. |
Références :
Dell DD, Stein DP. Exploring the Use of Medical Marijuana for Supportive Care of Oncology Patients. J Adv Pract Oncol. 2021 Mar;12(2):188-201.
Du Plessis SS, Agarwal A, Syriac A. Marijuana, phytocannabinoids, the endocannabinoid system, and male fertility. J Assist Reprod Genet. 2015;32(11):1575-1588. https://doi.org/10.1007/s10815-015-0553-8
Dumont L, Arkoun B, Jumeau F, et al. Assessment of the optimal vitrification protocol for pre-pubertal mice testes leading to successful in vitro production of flagellated spermatozoa. Andrology. 2015;3(3):611-625. https://doi.org/10.1111/andr.12042
Dumont L, Oblette A, Rondanino C, et al. Vitamin A prevents round spermatid nuclear damage and promotes the production of motile sperm during in vitro maturation of vitrified pre-pubertal mouse testicular tissue. Mol Hum Reprod. 2016;22(12):819-832. https://doi.org/10.1093/moleh r/gaw063
Dumont L. Effets de la congélation et de la vitrification sur le tissu testiculaire pré-pubère murin : impact sur la différenciation in vitro des spermatogonies souches, Thèse de doctorat en Biologie, sous la direction de Nathalie Rives, Rouen, École doctorale Normande de biologie intégrative, santé, environnement (Mont-Saint-Aignan, Seine-Maritime), 2016, 355 p.
Dumont L, Rives-Feraille A, Delessard M, et al. Activation of the cannabinoid receptor type 2 by the agonist JWH133 promotes the first wave of in vitro spermatogenesis. Andrology. 2021 Mar;9(2):673-688.
Grimaldi P, Di Giacomo D, Geremia R. The endocannabinoid system and spermatogenesis. Front Endocrinol (Lausanne). 2013;4:192. https://doi.org/10.3389/fendo.2013.00192
Grimaldi P, Orlando P, Di Siena S, et al. The endocannabinoid system and pivotal role of the CB2 receptor in mouse spermatogenesis. Proc Natl Acad Sci USA. 2009;106(27):11131-11136. https://doi.org/10.1073/pnas.08127 89106
Hou M, Andersson M, Eksborg S, Söder O, Jahnukainen K. Xenotransplantation of testicular tissue into nude mice can be used for detecting leukemic cell contamination. Hum Reprod. 2007;22(7):1899-1906. https://doi.org/10.1093/humrep/dem085
Jahnukainen K, Mitchell RT, Stukenborg J-B. Testicular function and fertility preservation after treatment for haematological cancer. Curr Opin Endocrinol Diabetes Obes. 2015;22(3):217-223. https://doi.org/10.1097/MED.00000 00000 000156
Kim SW, Roh J, Park CS. Immunohistochemistry for Pathologists: Protocols, Pitfalls, and Tips. J Pathol Transl Med. 2016 Nov;50(6):411-418. https://doi.org/10.4132/jptm.2016.08.08
Li X, Hua T, Vemuri K, et al. Crystal structure of the human cannabinoid receptor CB2. Cell. 2019;176(3):459-467.e13. https://doi.org/10.1016/j.cell.2018.12.011
Sato T, Katagiri K, Yokonishi T, et al. In vitro production of fertile sperm from murine spermatogonial stem cell lines. Nat Commun. 2011;2:472. https://doi.org/10.1038/ncomm s1478
Sugiura T, Kobayashi Y, Oka S, Waku K. Biosynthesis and degradation of anandamide and 2-arachidonoylglycerol and their possible physiological significance. Prostaglandins Leukot Essent Fatty Acids. 2002;66(2–3):173-192. https://doi.org/10.1054/plef.2001.0356
Wyns C, Curaba M, Vanabelle B, van Langendonckt A, Donnez J. Options for fertility preservation in prepubertal boys. Hum Reprod Update. 2010;16(3):312-328. https://doi.org/10.1093/humup d/dmp054
Zarandi NP, Galdon G, Kogan S, Atala A, Sadri-Ardekani H. Cryostorage of immature and mature human testis tissue to preserve spermatogonial stem cells (SSCs): a systematic review of current experiences toward clinical applications. Stem Cells Cloning. 2018;11:23-38. https://doi.org/10.2147/SCCAA.S137873
Ont participé au travail d’écriture de cet article, en collaboration le Dr. Ludovic Dumont, Ingénieur de Recherche (IGR, PhD) en Biologie de la Reproduction (par ordre alphabétique) : Bavart Noah, Boulet Ilona, Claux-Hardy Sarah, Deconinck Timéa, Destrebecq Louise, Genot Baptiste, Gramont Paul, Lebail Ninon, Maurice Flora, Minos Ludmilla, Pomorski Bastien, Rizzo Camille, Veyt Cloé.
Comment citer cet article : Ludovic Dumont et la 1ère-Terminale du lycée Groupe Scolaire Sévigné (Compiègne, FR), L’activation du récepteur aux cannabinoïdes de type 2 favorise la production de spermatozoïdes in vitro, Journal DECODER, 2024-06-30.
