Un traitement expérimental contre la maladie d’Alzheimer
Version Pdf
Marie Tautou1, et des élèves de Terminale spé SVT du lycée Episcopal de Mme Géraldine Stephan2 (la liste des élèves est mentionnée en fin d’article)
Article original/Original article: Tautou, Marie, Sabiha Eddarkaoui, Florian Descamps, Paul-Emmanuel Larchanché, Jamal El Bakali, Liesel Mary Goveas, Mélanie Dumoulin, et al. « A SS-Secretase Modulator Decreases Tau Pathology and Preserves Short-Term Memory in a Mouse Model of Neurofibrillary Degeneration ». Frontiers in Pharmacology 12 (2021): 679335. https://doi.org/10.3389/fphar.2021.679335.
Institution : 1Antineo, Bâtiment Bioserra 2, 2e étage 60F Avenue Rockefeller, 69008 – Lyon France
2Lycée Episcopal, 5 Rue du séminaire 68720 Zillisheim

Résumé :
La maladie d’Alzheimer est caractérisée par deux pathologies : la pathologie amyloïde et la pathologie tau. Cet article présente les résultats d’une étude visant à tester l’effet thérapeutique de 2 molécules, MAGS02-14 et PEL24-199, sur la pathologie tau. Les tests effectués sur des souris, montrent que PEL24-199 a eu un effet bénéfique sur la pathologie tau et a permis d’améliorer la mémoire à court terme. Ces données suggèrent ainsi un potentiel thérapeutique de PEL24-199 pour traiter la maladie d’Alzheimer.
Mots clés : Cerveau ; Maladie d’Alzheimer ; Maladie neuro-dégénérative ; Mémoire ; Neurone
I. Introduction
La maladie d’Alzheimer est une maladie neuro-dégénérative, c’est à dire qui touche progressivement le système nerveux. Cette maladie se manifeste par 2 lésions du système nerveux :
- la pathologie tau correspond à un assemblage dans les neurones, de protéines tau dû à une modification de la conformation de cette protéine. En temps normal, les protéines tau forment comme une sorte de filet entourant les microtubules. Les microtubules assurent la migration des chromosomes au cours des divisions cellulaires, mais aussi des protéines ou de tout autre « colis » intracellulaire. Dans le cas de la maladie d’Alzheimer, des groupements phosphates s’ajoutent à la protéine tau. Les protéines tau ainsi phosphorylées ne maintiennent plus les microtubules et s’accumulent dans le neurone formant des amas insolubles (Fig.1 et 3).

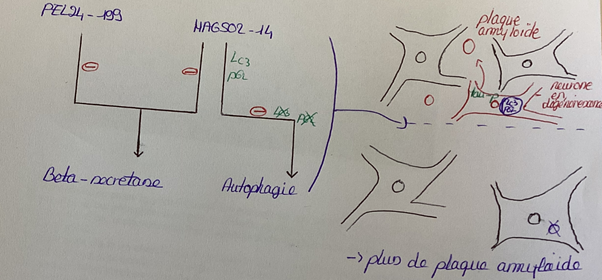
- la pathologie amyloïde correspond à la formation de plaques amyloïdes. Ces plaques sont un dépôt, à l’extérieur des neurones, de peptides Aβ toxiques. Ces peptides proviennent de la séparation de la protéine précurseuse de l’amyloïde (APP), cette séparation résulte de 2 clivages successifs de l’APP par 2 enzymes :la β-sécrétase et la γ-sécrétase (Fig.2 et 3).
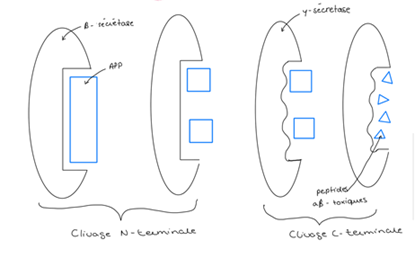
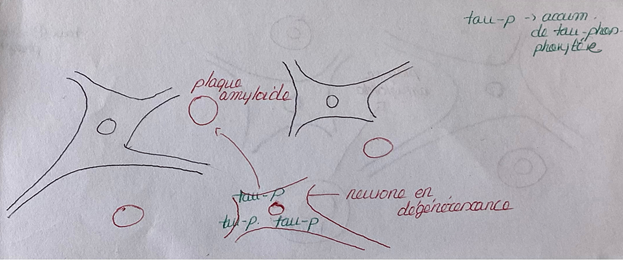
Le point commun entre ces 2 lésions est l’homéostasie protéique. En effet, elle regroupe l’ensemble des processus qui régulent la fabrication des protéines, leur dégradation et leur élimination. Parmi ces processus, on trouve l’autophagie (Fig.4) et les voies endosome/lysosome.
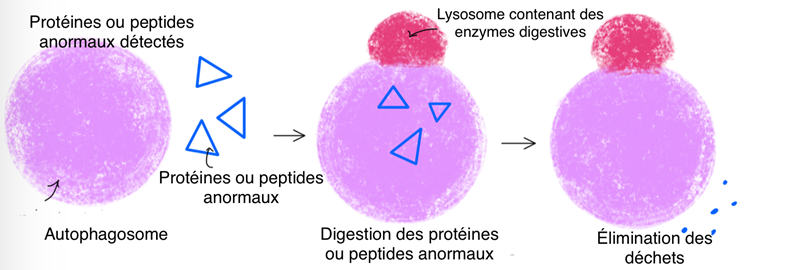
Dans le cas de la maladie d’Alzheimer, des études ont montré un dysfonctionnement de ces mécanismes puisque des protéines anormales telles que les protéines tau phosphorylées et les peptides Aβ ne sont pas éliminés. Des études ont également montré que des molécules telles que la chloroquine permettent de réduire ces dysfonctionnements de l’homéostasie protéique. Certaines molécules de la famille de la chloroquine seraient donc efficaces pour lutter contre la maladie, plus précisément contre la pathologie amyloïde ainsi que la pathologie tau qui sont les causes de la maladie. Il y a déjà deux molécules qui ont montré une activité thérapeutique. Les deux molécules testées parmi ces composés sont MAGS02-14 et PEL24-199. Ces molécules MAGS02-14 et PEL24-199 bloquent l’action de la β-sécrétase et permettent ainsi de lutter contre la formation de plaque amyloïde. L’effet de MAGS02-14 et PEL24-199 sur l’autophagie a également été testé dans une étude réalisée in vitro, c’est-à-dire réalisée en laboratoire en dehors d’organismes vivants. Dans le cas de la maladie d’Alzeihmer il y a eu une accumulation des marqueurs LC3 et p62 et gonflement des vésicules intracellulaire suite à un dysfonctionnement de l’autophagie. Les résultats de cette étude in vitro montrent que seule MAGS02-14 évite l’accumulation des marqueurs LC3 et P62, réduit le gonflement des vésicules et permet ainsi de restaurer l’autophagie. Ainsi, MAGS02-14 et PEL24-199 ont une action sur la pathologie amyloïde en bloquant l’action de la β-sécrétase, mais seule MAGS02-14 possède en plus une activité sur l’autophagie (Fig.5).
L’objectif de cette nouvelle recherche est d’examiner leur effet sur la phosphorylation de la protéine tau, l’autre manifestation de cette maladie. Les expériences ont été faites sur des souris modèle présentants une phosphorylation de la protéine tau. En comparant les résultats obtenus pour les souris traitées avec MAGS02-14 et celles traitées avec PEL24-199, on pourra déterminer si ces traitements entraînent une amélioration et si cette amélioration repose davantage sur le rétablissement de l’autophagie ou sur la régulation de la β-sécrétase, afin de mieux comprendre les mécanismes impliqués et orienter de futures approches thérapeutiques.
II. Méthode et résultats
1. Effets des traitements sur la mémoire à court terme
Test de l’anxiété
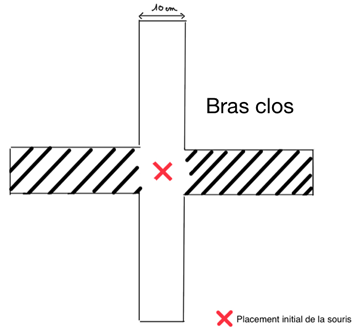
Le stress et l’anxiété seraient des facteurs interférants sur la mémoire. Les chercheurs réalisent alors un premier test sur des souris traitées et non traitées, appelé test du labyrinthe en croix surélevé dont la structure est la suivante (Fig.6).
Les bras clos abritent la souris : ce sont des lieux qui confortent la souris tandis que les bras ouverts peuvent lui sembler inconfortables. Des souris peu anxieuses auront de ce fait plus tendance à explorer l’ensemble des zones dont les bras sont ouverts alors que les souris anxieuses resteront plutôt dans les bras clos.
Après avoir placé les souris au centre du dispositif, on étudie leurs déplacements sur une durée de 5 minutes en mesurant différents paramètres : la distance parcourue, la vitesse, le nombre d’entrées dans chaque bras, le temps passé dans les bras ouverts par rapport aux bras clos et le pourcentage d’entrées dans les bras ouverts.
Test de la mémoire spatiale à court terme
Les chercheurs réalisent un second test sur les mêmes populations de souris, appelé test du labyrinthe en Y dont la structure est la suivante (Fig.7).
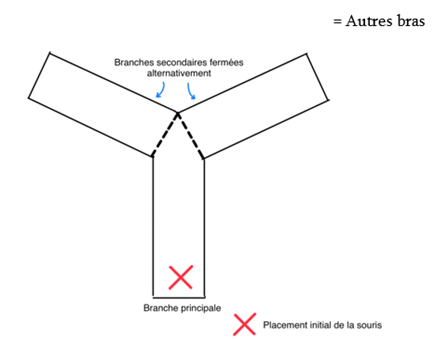
Cette structure est composée de 3 bras dont un bras de départ et deux bras alternativement fermés. On place d’abord la souris dans une aire ouverte composée du bras de départ et d’une première branche secondaire ouverte, pendant 5 min. On appelle cela la phase d’apprentissage. On l’extrait ensuite du dispositif pour la mettre dans sa cage durant 2 min. On appelle cela la phase de rétention. Le test commence lorsque l’on replace la souris dans le dispositif mais cette fois-ci en ouvrant également le bras qui était fermé initialement. On mesure alors les paramètres suivants sur une durée de 5 min : distance totale parcourue, vitesse, alternance entre les bras et entrée dans les 3 bras. On considère qu’une souris a une bonne mémoire à court terme, si pendant les 5 min de test, elle parcourt davantage le bras ouvert en deuxième partie que le premier bras découvert. Elle montre dans ce cas une mémorisation du premier bras exploré.
Deux traitements sont administrés à des souris ayant la pathologie tau : PEL24-199 ou MAGS02-14. Les souris jusqu’à l’âge de 6 mois possèdent déjà des accumulations de la protéine tau phosphorylée dans l’hippocampe (zone responsable de la mémoire et de l’apprentissage). Mais cette pathologie s’aggrave à partir de l’âge de 7 mois où les souris présentent des lacunes de mémoire spatiale qui s’aggravent au cours du temps et cela jusqu’à l’âge de 10 mois. Une fois cet âge passé, les déficits ne peuvent s’aggraver davantage.
Ainsi les tests comportementaux et de mémoire spatiale à court terme décrits précédemment ont été réalisés sur des souris âgées de 7 mois après 6 semaines de traitement
Résultats du test de l’anxiété
Suite au test du labyrinthe en croix surélevée, la mesure de l’anxiété a révélé que les traitements PEL24-199 et MAGS02-14 n’ont pas impacté les paramètres étudiés chez les deux populations de souris. Comme l’anxiété n’est pas modifiée à l’issue des tests, on peut donc en déduire qu’elle n’influe pas sur les résultats des tests de mémoire effectués.
Résultats du test de la mémoire spatiale à court terme
Lors du test du labyrinthe en Y, les souris atteintes de la pathologie tau, se rendent aléatoirement dans les bras du dispositif, et cela, à cause d’une diminution de la mémoire spatiale à court terme. Les souris atteintes de la pathologie tau âgées de 7 mois, traitées avec 1mg de MAGSO2-14 se rendent également aléatoirement dans les bras du dispositif, tandis que les souris traitées avec 1mg de PEL24-199 ont agi de la même manière que les souris n’ayant pas la pathologie tau, en explorant davantage le nouveau bras ouvert. Comme les souris traitées avec MAGS02-14 ne se sont pas rendues davantage dans le nouveau bras, on peut en déduire que ce traitement s’est montré inefficace pour pallier au déficit de la mémoire spatiale, contrairement au traitement PEL24-199 qui a permis de réduire ce déficit (Fig.8).
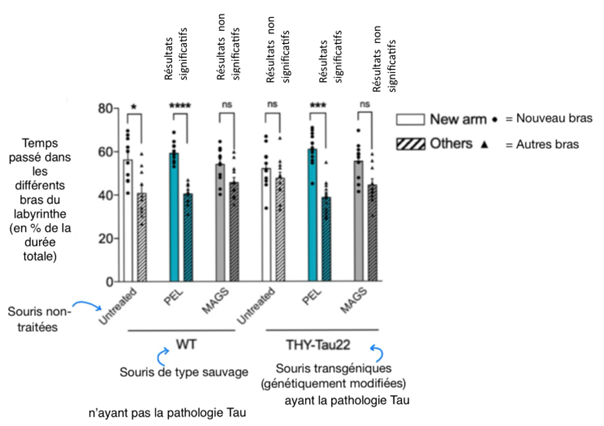
Le traitement PEL24-199 a donc permis de restaurer la mémoire à court terme chez des souris atteintes de la pathologie tau.
2. Effets des traitements sur la quantité de tau-phosphorylee
Protocole de séparation et d’identification des protéines tau phosphorylées
Les échantillons de cerveau de souris ayant une pathologie tau ont été préparés en mélangeant les tissus avec des solutions spécifiques afin d’extraire les protéines. Une fois homogénéisés, ils ont été chauffés à 70°C pour « déplier » les protéines. Une petite quantité de ces protéines a ensuite été déposée sur un gel de polyacrylamide, un matériau permettant de les trier selon leur taille sous l’effet d’un courant électrique. Ce procédé appelé électrophorèse agit comme un filtre où les protéines les plus petites migrent plus rapidement que les plus grandes (Fig.9).
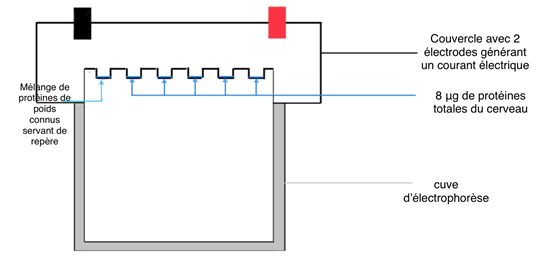
Une fois séparées, les protéines ont été transférées, grâce à un courant électrique, du gel à une fine membrane de cellulose capable de les retenir (Fig.10).
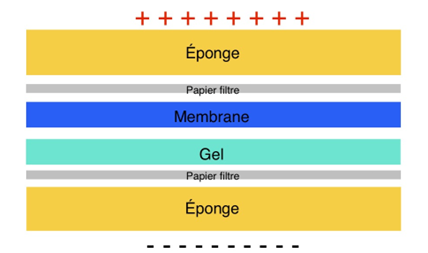
Pour identifier précisément la protéine tau et ses formes modifiées, des anticorps spécifiques ont été appliqués. Ces anticorps, grâce à une réaction chimique produisant de la lumière, ont permis de visualiser la présence et la quantité de tau sous forme d’images analysables (voir Fig.11). L’ensemble de ces étapes forment une technique appelée Western Blot qui permet la recherche et le dosage de protéines particulières dans un échantillon.
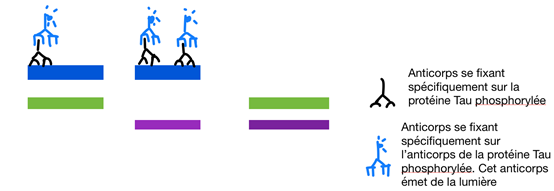
Une électrophorèse bidimensionelle a aussi été utilisée pour visualiser la quantité de tau phosphorylée. Le but de cette électrophorèse bidimensionelle est de séparer les différentes molécules en fonction de leur poids et de leur pH plus ou moins acide ou basique. On a ainsi séparé les protéines tau qui ont un poids de 64kda en fonction de leur pH. Ces protéines tau ont été extraites du cortex et de l’hippocampe des souris. On sait que quand la protéine tau est acide alors elle est défaillante (protéines tau phosphorylée).
Cette technique a été utilisée sur trois souris : une souris non traitée, ainsi qu’une souris avec le traitement PEL24-199 et l’autre avec le traitement MAGS02-14. Là encore, la protéine tau a été mise en évidence grâce à des anticorps spécifiques de la protéine et des anticorps spécifiques des anticorps émettant de la lumière.
Résultats :
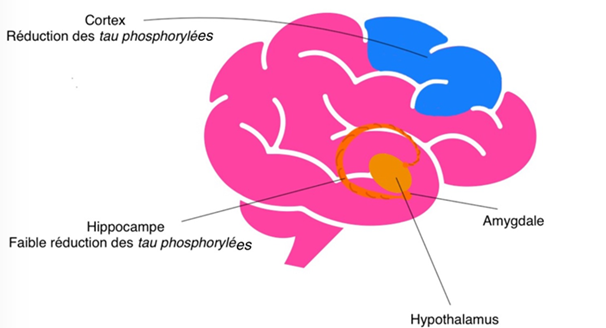
Le traitement avec PEL24-199 a eu un effet sur la modification chimique de la protéine tau dans le cerveau des souris étudiées. Plus précisément, dans le cortex, il a permis de réduire la présence de protéines tau phosphorylées. Cela signifie que le traitement influence un processus biologique qui joue un rôle dans la phosphorylation de la protéine tau.
Dans l’hippocampe, une diminution de la quantité de tau phosphoryléea également été observée, mais elle était moins marquée et n’a pas atteint un niveau considéré comme significatif d’un point de vue statistique.
En revanche, la quantité totale de tau dans le cerveau n’a pas changé après le traitement, ce qui montre que PEL24-199 n’empêche pas la production de tau mais modifie uniquement son état chimique. De plus, l’autre molécule testée, MAGS02-14, a eu un effet bien plus limité, avec une diminution détectée uniquement sur un site spécifique de phosphorylation de la protéine tau (S262).
L’électrophorèse bidimensionnelle montre que dans le cortex et l’hippocampe des souris non traitées, il y a beaucoup de protéines tau acide donc défaillante tandis qu’il y en a beaucoup moins avec le traitement PEL24-199 et le traitement MAGS02-14 (Fig.12).

L’ensemble de ces résultats montrent que PEL24-199 a un effet ciblé sur certaines modifications de tau dans le cerveau, avec une action plus visible dans le cortex que dans l’hippocampe (Fig 13).
3. Effets des traitements sur la formation d’amas insolubles de protéine tau
Protocole de préparation de la fraction de tau insoluble
Les tissus cérébraux de souris ayant une pathologie tau traitées ou non avec les molécules PEL24-199 et MAGS02-14, ont été prélevés. Les cellules de ces tissus ont été broyées afin de libérer leur contenu notamment leurs protéines. On obtient alors un homogénat de tissus cérébraux dans lequel on va quantifier la proportion de protéines tau insolubles. Pour ce faire, on commence par réaliser des centrifugations successives des homogénats cérébraux. Lors de la centrifugation, les éléments insolubles, vont s’accumuler au fond du tube tandis que les éléments solubles vont rester dans la partie supérieure du tube (Fig.14).
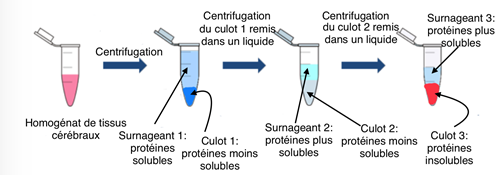
Les différentes fractions de centrifugations correspondant aux parties solubles ou insolubles ont été analysées par Western Blot (Fig 9,10 et 11) afin d’y rechercher et d’y quantifier les protéines tau, les protéines tau phosphorylées et les protéines tau non phosphorylées.
Résultats
Les résultats ont été exprimés sous forme de rapport entre la quantité de protéines présentes dans la fraction insoluble divisée par la quantité de protéines détectées dans la fraction soluble ajoutée à celle mesurée dans la fraction insoluble. Le traitement avec MAGS02-14 n’a eu aucun effet sur la formation d’amas insolubles de protéines tau phosphorylées dans les tissus cérébraux des souris atteintes de la pathologie tau. En revanche, le traitement PEL24-199 a permis de réduire la formation de ces amas insolubles de protéines phosphorylées dans les tissus cérébraux des souris atteintes de la pathologie tau.
4. Effets des traitements sur les astrocytes
Principes du test
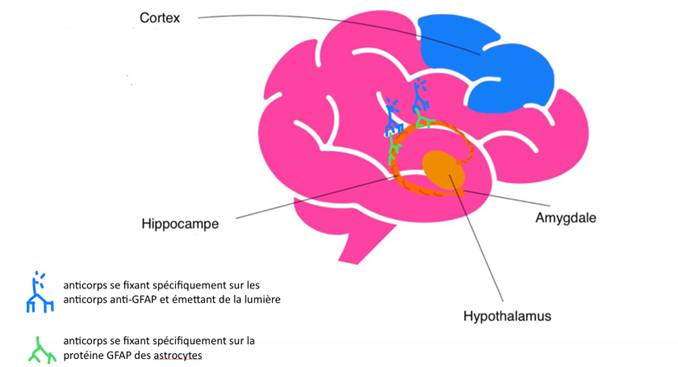
Les astrocytes sont des cellules gliales qui ont pour rôle de protéger les neurones. Dans le cas de la maladie d’Alzheimer, les astrocytes sont dysfonctionnels ce qui est marqué par l’accumulation d’une de leur protéine, la protéine GFAP. Les hippocampes de souris atteintes de la pathologie tau non traitées ou traitées avec MAGS02-14 ou PEL24-199 ont été prélevées. Des coupes ont été faites dans ces hippocampes et pour rechercher la présence de GFAP dans ces coupes, des anticorps anti GFAP ont été utilisés. Ces anticorps ont ensuite été mis en évidence par des anticorps émettant une lumière. Ainsi si GFAP est présent, après avoir administré les anticorps nous observerons plus de lumière, marquant un cerveau présentant des astrocytes dysfonctionnels (Fig.15).
Résultats
Le traitement avec MAGS02-14 n’a pas entraîné de changement significatif. En revanche, avec le traitement PEL24-199 il y a environ deux fois moins de zone avec GFAP et avec tau phosphorylées que sans traitement. Ainsi le traitement PEL24-199 permet de réduire la quantité de tau phosphorylée et limite le dysfonctionnement des astrocytes chez des souris atteintes de la pathologie tau.
III. Conclusion
Le traitement PEL24-199 a donc permis de réduire la phosphorylation des protéines tau et la formation d’amas insolubles de ces protéines dans les neurones de souris atteintes de la pathologie tau. Ce traitement a également permis de réduire le dysfonctionnement des astrocytes. Au final, le traitement a permis d’améliorer la mémoire à court terme des souris. Les traitements PEL24-199 et MAGS02-14 n’ont pas eu d’effets au niveau des processus d’autophagie dans l’organisme des souris. Ainsi PEL24-199 en plus de son action bloquant la β-sécrétase et donc la pathologie amyloïde, a également une action sur la pathologie tau. Cette étude ouvre donc la voie vers de nouveau traitements de la maladie d’Alzheimer agissant à la fois sur les 2 causes de la maladie : la pathologie amyloïde et la pathologie tau.
Références :
Tautou, Marie, Sabiha Eddarkaoui, Florian Descamps, Paul-Emmanuel Larchanché, Jamal El Bakali, Liesel Mary Goveas, Mélanie Dumoulin, et al. « A SS-Secretase Modulator Decreases Tau Pathology and Preserves Short-Term Memory in a Mouse Model of Neurofibrillary Degeneration ». Frontiers in Pharmacology 12 (2021): 679335. https://doi.org/10.3389/fphar.2021.679335.
Ont participé au travail d’écriture de cet article, en collaboration avec Marie Tautou, chercheur en neuroscience (par ordre alphabétique) : BENARBIA Hanaé, IAGARU Stefan-Alexandru, JAUD Amandine, JULLY Marylène, LAURENT Elise, MULLER Marion, PETRAGLIA Erine, PFIFFER Hugues, PLET Clovis, SCHERRER Anna, STRICH Pierre, VOJINOVIC Anastasija, WALTER Audrey
Comment citer cet article : Marie Tautou et des élèves de Terminale spé SVT du lycée Episcopal (Zillisheim, FR), Un traitement expérimental contre la maladie d’Alzheimer Journal DECODER, 2025-06-16
