Le milieu de vie aquatique des premiers tétrapodes : une histoire de delta ?

Institutions : 1Muséum national d’Histoire naturelle, Centre de Recherche en Paléontologie – Paris (CR2P), CNRS/MNHN/Sorbonne Université, CP 38, 57 rue Cuvier, F-75231 Paris cedex 05 (France)
2Collège Aimé Césaire de Saint-Geours-de-Maremne, 450 Avenue George Sand 40230 Saint Geours de Marenne
Vulgarisation scientifique / Programme DECODER* (2024) : Jean Goedert1 (chercheur) et la classe de 3ème B du collège Aimé Césaire de Mme Magali Dubeau2 et Mr Olivier Marié2 : Afonso Fernandes Beatriz, Ait Ininou Delcourt Shayna, Alonso Elena, Azaïs Cameron, Chaoui Nada, Chochoy-Vandecrux Leo, Colas Myla, Cribier Enola, Cristos Victoria, De Commines De Marsilly Juliette, Duizabo Léopold, Dupouy Aïnhoa, Fu Lucas, Lacan Pablo, Lafourcade Lohan, Lahourcade Zoé, Langeveld-Orrell Tarquin, Lassalle Naïcia, Laterrade Martin, Le Page Mahina, Leveau Sacha, Marcadieu Alice, Poloni Lizenn, Ribaudo Enzo, Vignola Chris, Yriarte Amaya, Zemour Fortuna Meï-Lin (la liste des élèves est aussi mentionnée en fin d’article)
Article original (2023) : Goedert, J., Lécuyer, C., Amiot, R., Arnaud-Godet, F., Wang, X., Cui, L., Cuny, G., Douay, G., Fourel, F., Panczer, G., Simon, L., Steyer, J.-S., and Zhu, M. (2018). Euryhaline ecology of early tetrapods revealed by stable isotopes. Nature, 558(7708), 68-72.

Résumé
Les tétrapodes (vertébrés possédant 4 membres munis de doigts) sont apparus au Dévonien supérieur (il y a environ 375 Ma). Leurs membres ne leur permettaient pas de marcher en milieu terrestre, ils étaient encore inféodés aux environnements aquatiques. Depuis plus d’un siècle les scientifiques se posent la question si les premiers tétrapodes et leur faune de vertébrés associée vivaient en milieu d’eau douce ou en milieu marin ? Les analyses des sédiments qui contiennent ces fossiles ont permis de leur attribuer un milieu de vie aquatique d’eau douce. Cependant, le milieu de fossilisation est parfois différent du milieu de vie. En effet, d’éventuels courants d’eau peuvent déplacer les corps des animaux après leur mort et ainsi conduire à une mauvaise interprétation du milieu de vie des premiers tétrapodes. L’étude d’éléments chimiques comme le soufre et l’oxygène contenus dans les os fossilisés de l’animal reflète leur alimentation et donc leur véritable milieu de vie ; l’analyse de la composition isotopique stable*, du soufre et de l’oxygène des os a donc été utilisée dans cette étude afin de déterminer le milieu de vie des premiers tétrapodes. Nous démontrons ici que les milieux de vie aquatiques des premiers tétrapodes et de leur faune de vertébrés associée étaient à la fois soumis à une influence d’eau douce et d’eau salée et donc que ceux-ci ne vivaient pas exclusivement dans les milieux d’eau douce comme nous le pensions. Cette faculté d’adaptation a pu favoriser la survie de ce groupe lors de la crise biologique de la fin du Dévonien qui a provoqué la disparition d’au moins 70% des espèces.
Mots clés : isotope stable ; δ34S ; δ18O ; eau douce ; eau marine ; salinité de l’eau ; principe d’actualisme ; euryhalinité ; tétrapode ; Dévonien ; fossiles ; Acanthostega ; Ichthyostega
I. Introduction
Les premiers tétrapodes – vertébrés à quatre membres munis de doigts – sont apparus à la fin du Dévonien, il y a environ 375 millions d’années (Ahlberg, 1995) comme le montre la découverte de squelettes fossilisés. Ils apparaissent peut-être même encore plus tôt, au milieu du Dévonien (il y a environ 395 millions d’années), comme le montre la découverte de pistes d’empreintes (Niedźwiedzki et al., 2010). Bien qu’ils possédaient des membres pourvus de doigts (Coates & Clack, 1990), l’étude détaillée de leur squelette révèle qu’ils étaient incapables de se mouvoir en milieu terrestre et qu’ils habitaient encore les milieux aquatiques (Clack et al., 2003; Coates & Clack, 1990; Pierce et al., 2012). Depuis plus de 100 ans une question suscite de nombreux débats au sein de la communauté paléontologique : s’agit-il d’environnements aquatiques marins ou d’eau douce ?
La méthode principale pour étudier les milieux de vie des espèces fossiles repose sur l’analyse des sédiments qui les contiennent. Si les sédiments sont des sédiments déposés en milieu d’eau douce alors on émettra l’hypothèse que les organismes fossiles qu’ils contiennent vivaient en milieu d’eau douce ; et inversement pour les sédiments interprétés comme ayant été déposés en milieu marin, on émettra l’hypothèse que les organismes fossiles qu’ils contiennent vivaient en milieu marin. Toutefois, à leur mort, les organismes peuvent être plus ou moins transportés avant d’être enfouis dans des sédiments ; si bien que les sédiments qui les contiennent ne reflètent pas toujours leur milieu de vie.
Historiquement, la question de l’environnement de vie des premiers tétrapodes a donc été étroitement liée à l’interprétation environnementale d’un type de sédiments caractéristiques de la période de la fin du Dévonien appelés les Vieux Grès Rouge. Ces sédiments ont très tôt attiré l’attention des paléontologues, car ils contiennent une grande diversité de « poissons » fossiles (Agassiz, 1844; Woodward, 1889) ainsi que les premiers tétrapodes connus (Säve-Söderbergh, 1932). Historiquement, les sédiments des Vieux Grès Rouges ont été interprétés comme le produit de l’érosion d’une chaîne de montagnes (McClay et al., 1986) qui se seraient déposés dans des bassins continentaux et donc dans des environnements aquatiques d’eau douce (Godwin-Austen, 1855). Quinze ans avant que les paléontologues ne découvrent les restes fossilisés de ces premiers tétrapodes dans les sédiments des Vieux Grès Rouges le géologue américain Joseph Barrell avait émis l’hypothèse que ces animaux avaient dû habiter et évoluer dans les environnements d’eau douce représentés par les sédiments des Vieux Grès Rouges (Barrell, 1916).
Ainsi, lorsque les premiers tétrapodes Ichthyostega et Acanthostega ont été effectivement découverts dans les sédiments des Vieux Grès Rouges de l’Est du Groenland, la prédiction de Joseph Barrell a donné naissance à un paradigme* durable : les premiers tétrapodes et leur faune associée habitaient des environnements d’eau douce. Cependant, ce point de vue a été remis en question par de nombreux paléontologues, qui ont défendu l’idée que les sédiments des Vieux Grès Rouges ont pu être soumis à des influences marines plus importantes qu’on ne le pensait, et que les premiers tétrapodes ont pu tolérer des salinités plus élevées (Bray & Lawson, 1985; Carr & Jackson, 2008; Laurin & Soler-Gijón, 2010; Schmitz et al., 1991; Schultze & Cloutier, 1996). Depuis la découverte d’Ichthyostega et d’Acanthostega, d’autres fossiles de premiers tétrapodes (Ahlberg, 1995; Ahlberg et al., 1994; Campbell & Bell, 1977; Clack et al., 2012; Clément et al., 2004; Daeschler et al., 1994; Lebedev, 2004; LEBEDEV & CLACK, 1993; Shubin et al., 2004; Zhu et al., 2002) et des pistes d’empreintes (Niedźwiedzki et al., 2010) ont été découverts dans le monde entier dans des dépôts sédimentaires reflétant des environnements marins, saumâtres ou d’eau douce (Blieck et al., 2007). Ces diverses interprétations ont relancé le débat sur les milieux de vie des premiers tétrapodes et de leur faune associée. Cependant, cette question n’est toujours pas résolue, en raison du manque de traceurs environnementaux directs qui pourraient aider à déchiffrer le milieu de vie des premiers tétrapodes.
D’un point de vue chimique on peut considérer les ossements fossilisés comme un mélange de matière acquise dans les tissus osseux lors de la vie de l’animal et de la matière secondairement acquise après la mort de l’animal, lors des processus de fossilisation (Trueman & Tuross, 2002). Les éléments chimiques incorporés dans les tissus osseux lors de la vie de l’animal proviennent majoritairement de leur alimentation et reflètent donc leur environnement de vie (Martin et al., 2017). Parmi ces éléments chimiques, le soufre et notamment sa composition isotopique stable (voir partie méthode) possède des valeurs très différentes entre les environnements marins et d’eau douce (Nehlich, 2015).
Nous utilisons dans cette étude la composition isotopique stable du soufre et de l’oxygène (qui permet également de différencier les environnements de vie aquatique) de l’os afin de tracer directement les environnements de vie des premiers tétrapodes (Figure 1). Dans un premier temps, nous démontrons que cette nouvelle méthode fonctionne sur des vertébrés actuels provenant de différents types d’environnements aquatiques. C’est le principe d’actualisme*. Dans un second temps nous appliquons cette méthodologie à des restes fossilisés de premiers tétrapodes et leur faune associée de la fin du Dévonien provenant de deux régions géographiques (Figure 1.1) : l’Est du Groenland et la région autonome chinoise de Ningxia Hui.
II. Matériels et méthodes
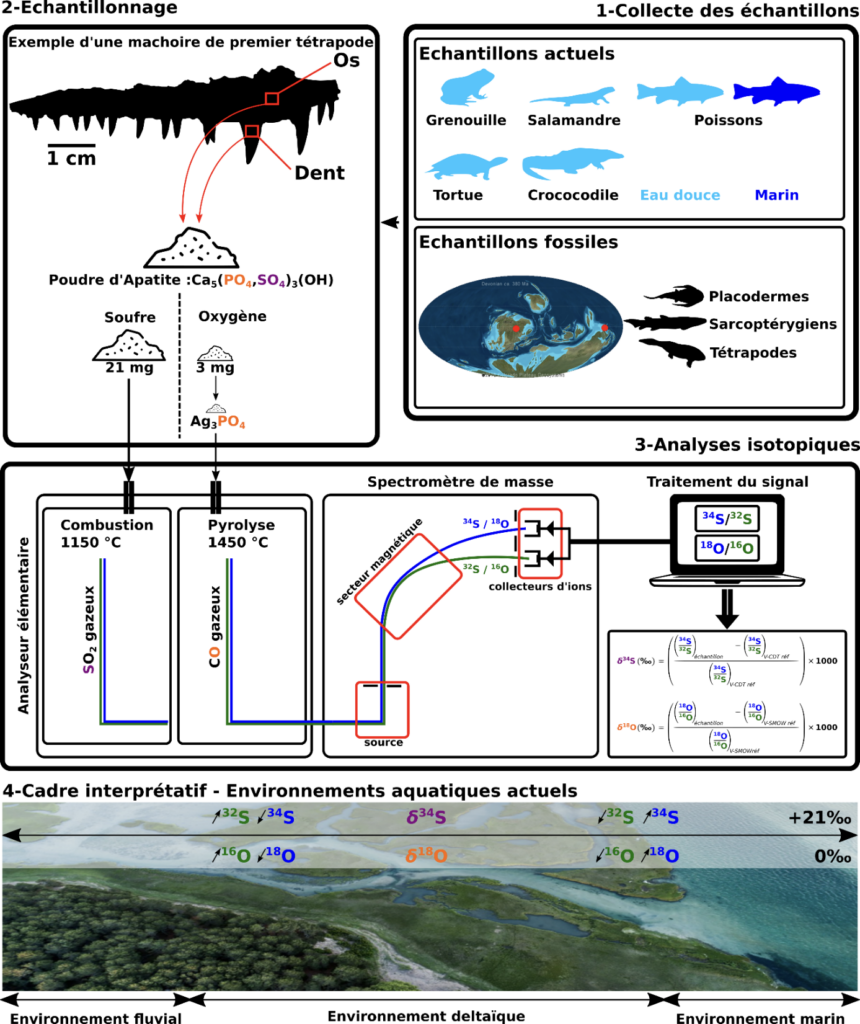
Figure 1. Représentation graphique de la méthodologie employée. 1. Des échantillons de vertébrés actuels vivant dans des milieux d’eaux douces et marins ont été collectés. Des échantillons fossiles provenant de deux localités du Dévonien supérieur ont également été collectés. 2. Pour chaque échantillon, une quantité de poudre d’apatite* (la partie minéralisée des tissus squelettiques) est prélevée. 21 mg de poudre sont réservés à l’analyse isotopique du soufre et 3 mg à l’analyse isotopique de l’oxygène. Avant l’analyse isotopique de l’oxygène, les ions phosphates (PO43-) de l’apatite sont extraits spécifiquement sous la forme de phosphate d’argent Ag3PO4 qui sert de support à l’analyse. 3. Les poudres sont ensuite introduites dans un analyseur élémentaire qui permet, via respectivement une combustion et une pyrolyse, de transformer le soufre de l’apatite et l’oxygène du phosphate d’argent sous la forme de dioxyde de soufre (SO2) et de monoxyde de carbone (CO) gazeux. Ces gaz sont alors conduits vers la source d’un spectromètre de masse qui permet de les ioniser. Les ions sont ensuite conduits vers un secteur magnétique qui permet de les séparer en fonction de leur rapport masse sur charge. Ainsi, l’isotope lourd (34S/18O) est séparé de l’isotope léger (32S/16O) et tous deux sont collectés dans des cages de faraday dédiés. Le signal ionique est converti en signal électrique et traité par ordinateur pour calculer les rapport isotopiques 34S/32S et 18O/16O d’un échantillon. L’analyse isotopique d’échantillons de référence permet ensuite d’exprimer ces rapports isotopiques sous les formes conventionnelles de δ34S et δ18O, exprimés en ‰ par rapport aux références internationales V-CDT et V-SMOW, respectivement. 4. Dans les environnements aquatiques actuels les environnements d’eau douce sont relativement appauvris en isotopes lourds (34S, 18O) et enrichis en isotopes légers (32S, 16O) par rapport aux environnement marins, et inversement.
Les environnements marins actuels ont en général une valeur de δ34S et de δ18O proche de +21‰ et 0‰, respectivement.
Collecte des échantillons actuels. Les quatre tortues de Floride (Trachemys scripta elegans ; échantillons Tr-sc-1, Tr-sc-3-5) et les deux dents de crocodile du désert (Crocodylus suchus ; échantillons Cr-su-1 et Cr-su-2) ont été prélevés au zoo du Parc de la Tête-d’Or de Lyon, en France. L’eau a été échantillonnée directement dans les bassins dans lesquels ces animaux sont gardés. L’échantillon de salamandre tachetée (Salamandra salamandra ; échantillon Sal-sal-1) provient de la collection zoologique du Centre de Ressources pour les Sciences de l’Évolution (CERESE, FED 4271, Villeurbanne, France). L’eau a été échantillonnée à l’endroit d’où provient le spécimen (Bazas, Gironde, France). Les cinq grenouilles rieuses (Pelophylax ridibundus ; échantillons Pe-ri-1-5) ont toutes été prélevées dans un élevage à Pierrelatte (Drôme, France), ainsi que l’eau de leur bassin et leur nourriture. Les quatre truites (Oncorhynchus mykiss, Salvelinus fontinalis et Salmo trutta ; échantillons On-my-2, On-my-3, Sa-fo-2 et Sa-tr-2) ont toutes été prélevées dans un élevage situé sur la commune d’Allons (Gironde, France), ainsi que l’eau de leur bassin et leur nourriture. Le silure glane (Silurus glanis ; échantillon Si-gl-1) et la carpe commune (Cyprinus carpio ; échantillon Cy-ca-1) ont été collectés dans un étang de la Dombes (Ain, France), exploité par la Maison Liatout. Les autres espèces de poissons (Sandre doré européen, Sander lucioperca, échantillon Sa-lu-1 ; Bar commun, Dicentrarchus labrax, échantillon Di-la-1 ; Sole commune, Solea solea, échantillon So-so-1 ; Limande commune, Limanda limanda, échantillon Li-li-1 ; Morue de l’Atlantique, Gadus morhua, échantillon Ga-mo-1 ; Saumon rouge, Oncorhynchus nerka, échantillon On-ne-1) ont toutes été collectées à la poissonnerie Maison Pupier à Lyon.
Collecte des échantillons fossiles. Les 40 échantillons de vertébrés du Dévonien du Groenland oriental ont été sélectionnés principalement à partir de spécimens non numérotés conservés dans la collection paléontologique du Musée d’histoire naturelle du Danemark, de l’Université de Copenhague. Ces échantillons ont été rapportés à l’occasion d’expéditions paléontologiques menées dans les années 1930-1950 par les paléontologues G. Säve-Söderbergh, E. Jarvik et G. Wängsjö. Les localités du Dévonien du Groenland oriental sont situées (du nord au sud) sur Gauss Halvø, Ymer Ø, Ella Ø, Traill Ø, Wegener Halvø et Canning Land51. Les restes de tétrapodes fossiles proviennent du groupe Celsius Bjerg du Dévonien supérieur, qui se compose principalement de siltstones et de grès. Ces sédiments ont été précédemment interprétés comme ayant été principalement déposés dans des conditions fluviatiles d’eau douce (Olsen & Larsen, 1993). Le groupe Celsius Bjerg se compose des formations sédimentaires Agda Dal, Elsa Dal, Aina Dal, Wimans Bjerg, Britta Dal, Stensiö Bjerg et Obrutschew Bjerg (Blom et al., 2007). Parmi ces formations, des restes de tétrapodes n’ont été rapportés que dans deux formations : les formations d’Aina Dal et de Britta Dal, qui forment – avec la formation moins fossilifère de Wimans Bjerg – ce que l’on appelle communément la “série à Remigolepis “(Blom et al., 2007). Nous avons donc sélectionné principalement des échantillons de la série à Remigolepis (34 échantillons sur 40, voir table 1). Deux échantillons fossiles proviennent de la “série à Phyllolepis“, qui regroupe les formations d’Agda Dal et d’Elsa Dal et se situe, stratigraphiquement, immédiatement au-dessus de la série à Remigolepis. Trois échantillons fossiles proviennent de la “série à Asterolepis“, qui est stratigraphiquement inférieure aux séries à Remigolepis et à Phyllolepis (Blom et al., 2007). Sur la base d’une analyse des miospores, un âge Famennien a déjà été proposé pour les séries à Remigolepis et à Phyllolepis (Marshall et al., 1999). Les 11 échantillons de vertébrés du Dévonien provenant de la région autonome chinoise de Ningxia Hui ont été collectés à l’Institut de paléontologie des vertébrés et de paléoanthropologie de Pékin, en Chine. Ces échantillons proviennent de la formation de Zhongning (Pan et al., 1987), qui a livré les restes de Sinostega pani– qui est la première description d’un tétrapode dévonien d’Asie (Zhu et al., 2002). La formation de Zhongning se compose principalement de siltites, de grès quartzeux feldspathiques et de calcaires arénacés, qui ont tous été interprétés comme ayant été déposés dans des conditions non marines (Zhu et al., 2002). Sur la base d’une analyse des miospores, un âge Famennien a été proposé pour la formation de Zhongning (Crowson et al., 1991) . Pour chaque spécimen, environ 100 mg de poudre d’os ont été prélevés à l’aide d’un foret à tête sphérique et diamantée.
Analyse du δ18Op. Tous les échantillons d’apatite osseuse ont été traités selon un protocole de chimie humide précédemment décrit (Crowson et al., 1991), légèrement modifié par Lécuyer et al. (1993). Ce protocole consiste à isoler le phosphate (PO43-) de l’apatite sous forme de cristaux de phosphate d’argent (Ag3PO4), en utilisant une dissolution acide et une résine échangeuse d’anions. Pour chaque échantillon, 20-30 mg de poudre d’émail ont été dissous dans 2 mL d’acide fluorhydrique (HF) 2 M pendant une nuit. Le résidu de CaF2 a été séparé par centrifugation et la solution a été portée à pH neutre en ajoutant 2,2 mL de KOH 2 M. Une résine échangeuse d’anions Amberlite (2,5 mL) a été ajoutée à la solution pour séparer les ions PO43-. Après 24 h, la solution a été retirée et la résine a été éluée avec 6 mL de NH4NO3 0,5 M. Après 4 h, 0,5 mL de NH4OH et 15 mL d’une solution ammoniacale d’AgNO3 ont été ajoutés et les échantillons ont été placés dans un bain thermostaté à 70 °C pendant 7 h, ce qui a permis la précipitation des cristaux d’Ag3PO4. Les compositions isotopiques de l’oxygène ont été mesurées par une technique de pyrolyse à haute température utilisant un analyseur élémentaire VarioPYROcube connecté en flux continu à un spectromètre de masse à rapport isotopique Isoprime (technique « EA-Py-CF-IRMS »(Fourel et al., 2011; Lécuyer et al., 2007), réalisée au laboratoire de Géologie de Lyon, UMR CNRS 5276). Pour chaque échantillon, 5 aliquotes de 300 μg d’Ag3PO4 ont été mélangées à 300 μg de poudre de graphite pur et chargées dans des capsules en argent. La pyrolyse a été réalisée à 1 450 °C. Les mesures ont été calibrées par rapport au NBS120c (phosphorite naturelle du Miocène de Floride) et au NBS127 (sulfate de baryum, BaSO4 : δ18O = 9,3 ‰). La valeur du NBS120c a été fixée à 21,7‰ (VSMOW) (Lécuyer et al., 1993). Les échantillons de phosphate d’argent précipités à partir du standard NBS120c ont été analysés à plusieurs reprises (δ18Op = 21,8 ‰ ; 1σ = 0,3 ; n = 10). Ces échantillons de phosphate d’argent dérivés du standard NBS120c ont été réalisés durant les mêmes phases de traitement chimique que celles appliquées aux échantillons de bioapatites fossiles pour s’assurer qu’aucun fractionnement isotopique ne s’est produit au cours de la chimie humide. L’écart-type moyen était de 0,25 ± 0,11‰. s.e.m. Les données sont rapportées en tant que valeurs de δ18Op et exprimée en « ‰ » par rapport à la référence internationale VSMOW.
Analyse du δ34S. Les échantillons d’eau ont été filtrés sur un système Millipore à l’aide de filtres en acétate de cellulose de 0,45-μm. Les solutions filtrées ont ensuite été chauffées à 70 °C et une solution de dichlorate de baryum (BaCl2) à 5 % a été ajoutée goutte à goutte pour précipiter les sulfates (SO42-) sous forme de sulfate de baryum (BaSO4). Les compositions isotopiques du soufre ont été mesurées à l’aide d’un analyseur élémentaire VarioPYROcube en mode de combustion NCS connecté en mode flux continu avec un spectromètre de masse à rapport isotopique Isoprime 100 à la plateforme d’Écologie Isotopique hébergée par le Laboratoire d’Écologie des Hydrosystèmes Naturels et Anthropisés’ (LEHNA, UMR CNRS 5023, Villeurbanne, France). Les sulfates de baryum des échantillons d’eau ont été analysés en pesant 3 aliquotes de 250 μg dans des capsules en étain. Les mesures ont été étalonnées par rapport aux trois références internationales de sulfate de baryum, NBS127, IAEA-SO-5 et IAEA-SO-6. Les échantillons d’os ont été analysés en pesant 3 aliquotes de 7 mg de poudre d’apatite fossile ont été mélangées à 20 mg de poudre d’oxyde de tungstène (WO3) pur et chargées dans des capsules en étain. L’oxyde de tungstène est un oxydant puissant qui assure la décomposition thermique complète du sulfate d’apatite en dioxyde de soufre (SO2) gazeux (Olsen & Larsen, 1993). Les mesures ont été calibrées par rapport aux références internationales NBS127 et S1 (sulfure d’argent, Ag2S). Pour chaque série d’analyses d’échantillons d’os, nous avons également analysé des échantillons de BCR32 en tant que standard compositionnel (S% = 0,72 %, valeur certifiée) et isotopique (δ34S = 18,4 ‰(Fourel et al., 2015; Goedert et al., 2016)) afin de nous assurer que les conditions analytiques étaient optimales pour effectuer des analyses isotopiques du soufre sur des échantillons à faible teneur en soufre (apatite de l’os). L’écart-type des mesures de δ34S est < à 0,3‰. Les données sont rapportées en tant que valeurs de δ34S et exprimée en « ‰ » par rapport à la référence internationale VCDT. L’analyseur élémentaire VarioPYROcube a également été utilisé pour mesurer la teneur en soufre des échantillons.
Résultats
- Résultats obtenus pour les vertébrés actuel
On cherche à vérifier si les valeurs de δ34S des tissus osseux des vertébrés actuels échantillonnés sont en accord avec les valeurs de δ34S de l’eau dans laquelle ils vivent (pour pouvoir ensuite utiliser cette méthode sur les tétrapodes fossiles). Les résultats obtenus sont présentés dans la Figure 2.
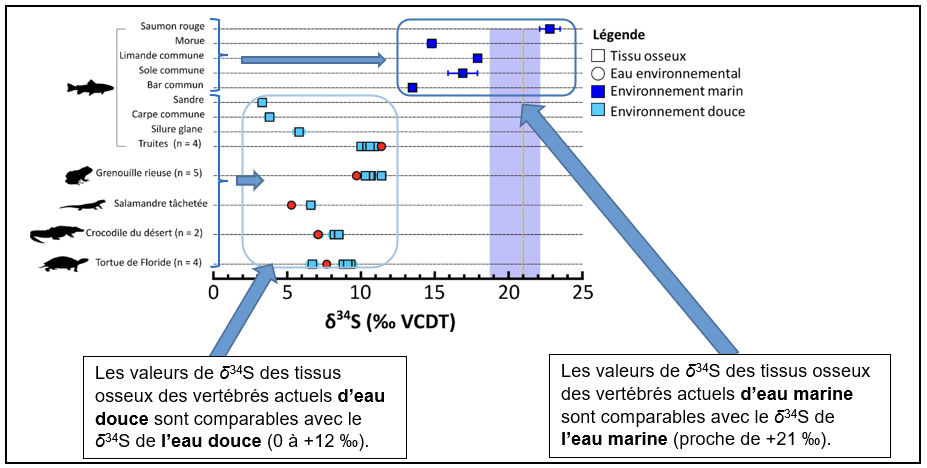
Les résultats démontrent que les valeurs de δ34S des tissus osseux permettent :
- de tracer directement la salinité des milieux de vie.
- de différencier les espèces vivant dans les environnements marins de celles vivant dans les environnements d’eau douce.
Nous pouvons ainsi utiliser le principe d’actualisme pour appliquer cette méthode sur les tissus osseux des premiers tétrapodes afin de déterminer le type d’eau dans lequel ils vivaient. Elle sera complétée par l’étude de la composition isotopique de l’oxygène (δ18O) de l’os qui est également un traceur des environnements aquatiques déjà connu.
- Résultats obtenus pour les premiers tétrapodes
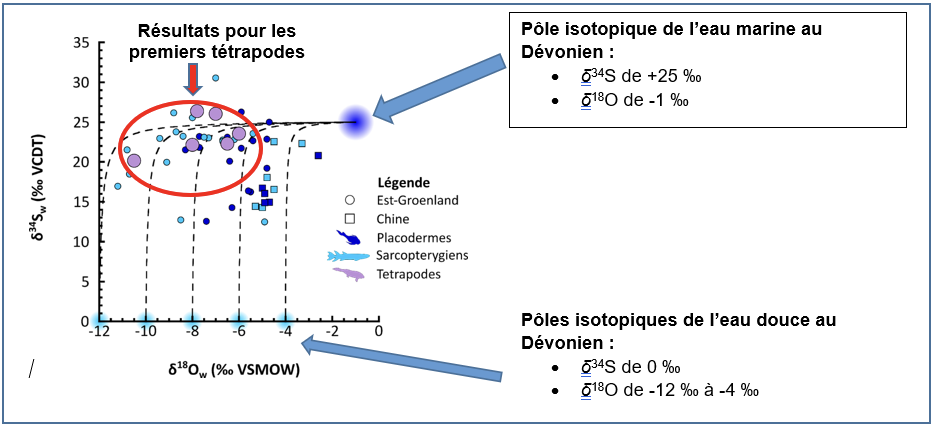
| δ34S (‰) | δ18O (‰) | |
| Eau douce dévonienne | 0 | De -12 à -4 |
| Eau marine dévonienne | +25 | -1 |
| Résultats : Tissus osseux des premiers tétrapodes et de leur faune associée | De +20 à +26 | De -11 à -4 |
Tableau 1. Comparaison de la composition isotopique des eaux douces dévoniennes, de l’eau marine dévonienne et de celles déduites des valeurs de δ34S et de δ18O des tissus osseux des premiers tétrapodes.
IV. Discussion
Nous constatons que les six échantillons de premiers tétrapodes mesurés ont des valeurs de composition isotopique du soufre élevées (de +20 à +26 ‰ ; Figure 3), qui sont donc compatibles avec celles de l’eau marine dévonienne (de +25 ‰) qui traduisent donc l’influence marine de leur environnement de vie. Cependant, nous constatons également que leurs valeurs de composition isotopique de l’oxygène (de -11 à -6 ‰) sont compatibles avec celles des eaux douces dévoniennes (-12 à -4 ‰), mettant ainsi en évidence une quantité importante d’eau douce dans leur environnement. La composition isotopique du soufre et de l’oxygène des os des premiers tétrapodes enregistre donc à la fois l’influence d’eau marine et d’eau douce de leur environnement de vie aquatique.
La salinité joue un rôle primordial dans la structuration des écosystèmes aquatiques actuels. De nombreuses espèces de poissons sont capables de tolérer des environnements aquatiques de salinités variables. Au sein d’une même espèce on observe des individus résidant toute leur vie dans un environnement aquatique de salinité donné et d’autres individus résidant toute leur vie dans un environnement aquatique de salinité différente. On parle dans ce cas d’euryhalinité* au sens écologique. Toujours au sein d’une même espèce certains individus fréquentent des environnements aquatiques de salinités variables au cours de leur vie, ils sont capables de migrer par exemple d’un environnement d’eau douce à un environnement marin (comme les saumons ou les anguilles par exemple), on parle alors d’euryhalinité au sens physiologique. Dans notre étude nous avons effectué une analyse unique par échantillon il n’est donc pas possible de dire si les valeurs isotopiques traduisant à la fois une influence d’eau douce et d’eau marine sont le résultat d’un comportement migratoire entre des masses d’eau de salinités différentes (euryhalinité écologique) ou seulement d’un comportement sédentaire dans des environnements aquatiques de transition à la salinité variable (estuaires et deltas).
Une étude récente publiée par Goedert et al. (2024) démontre que les compositions isotopiques du soufre et de l’oxygène des tissus squelettiques fossilisés permettent de tracer finement la salinité relative de différents environnements aquatiques le long d’un système fluviatile jusqu’aux environnements marins côtiers. Cette même étude suggère également que les premiers tétrapodes trouvés dans les gisements pennsylvaniens (USA) de la fin du Dévonien seraient quant à eux cantonnés aux environnements aquatiques d’eau douce.
Les rares données isotopiques disponibles à ce jour pour des espèces de premiers tétrapodes et de leur faune de vertébrés associés (Goedert et al., 2018, 2024) suggèrent donc que la salinité structurait déjà fortement les écosystèmes aquatiques du Dévonien supérieur et que différentes espèces de premiers tétrapodes fréquentaient des environnements de différentes salinités.
A l’aune de ces résultats, la vision archaïque et simplifiée – mais toujours étonnement tenace dans la littérature (Lu et al., 2024) – des grandes transitions écologiques qui se mettent en place à la fin du Dévonien apparaît beaucoup plus complexe lorsqu’on l’étudie à travers le prisme de la salinité ; ce qui ne devrait pas nous étonner compte tenu de ce qu’on observe dans les environnements aquatiques actuels.
V. Conclusion
Les valeurs de δ34S et de δ18O des os des premiers tétrapodes traduisent à la fois l’influence marine et d’eau douce de leur milieu de vie. On en déduit donc qu’au moins certaines espèces de premiers tétrapodes vivaient dans des environnements de transition tels que les estuaires ou les deltas. En effet, dans ces environnements, les eaux marines se mélangent aux eaux douces, la salinité y est donc variable.
Certaines espèces de premiers tétrapodes étaient donc probablement adaptées à tolérer une grande gamme de salinité (ce qui n’est pas le cas de toutes les espèces) : on appelle cette capacité l’euryhalinité.
On peut supposer que cette capacité à tolérer de larges gammes de salinité leur aurait permis de trouver des environnements aquatiques « refuges » et de survivre à la crise biologique qui affecte largement les environnements marins à la fin du Dévonien et qui a provoqué la disparition d’au moins 70% des espèces sur la Terre(McGhee Jr, 2006).
| LEXIQUE Isotope : qualifie des éléments chimiques ayant le même nombre de protons mais un nombre différent de neutrons (exemples pour les isotopes stables du soufre : 32S, 33S, 34S et 36S). Isotope stable : isotopes qui ne se désintègrent pas avec le temps, contrairement aux isotopes radioactifs. Paradigme : ensemble de croyances, de valeurs, de techniques et de méthodes partagées par une communauté scientifique ou un groupe social. Il constitue le cadre de référence à partir duquel ces groupes interprètent et comprennent le monde. Principe d’actualisme : théorie en géologie qui postule que les processus géologiques actuels se sont déroulés de la même manière tout au long de l’histoire de la Terre. Ce principe permet aux géologues de comprendre l’histoire de la Terre en observant les processus actuels. Apatite : minéral qui compose les tissus squelettiques (os, dent, écaille) dont la formule chimique générale est : Ca5(PO4)3(OH). Le soufre est présent en petite quantité (< 1% en masse) dans les apatites sous la forme de sulfates (SO42-) qui remplacent les groupements phosphates (PO43-) dans la maille cristalline. Euryhalinité : capacité de certains organismes aquatiques à tolérer une large gamme de salinité dans leur environnement. |
Références :
Agassiz, L. (1844). Monographie Des Poissons Fossiles Du Vieux Grès Rouge Ou Système Dévonien (Old Red Sandstone) Des Iles Britanniques Et De Russie, Par L. Agassiz. Ouvrage rédigé à la demande de l’Association Britannique pour l’avancement des sciences et présenté par extraits à sa réunion à Manchester en 1842 (Vol. 2). Aux frais de l’auteur.
Ahlberg, P. E. (1995). Elginerpeton pancheni and the earliest tetrapod clade. Nature, 373(6513), 420‑425.
Ahlberg, P. E., Luksevics, E., & Lebedev, O. (1994). The first tetrapod finds from the Devonian (Upper Famennian) of Latvia. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 343(1305), 303‑328.
Barrell, J. (1916). Influence of Silurian-Devonian climates on the rise of air-breathing vertebrates. Bulletin of the Geological Society of America, 27(1), 387‑436.
Blieck, A., Clement, G., Blom, H., Lelievre, H., Luksevics, E., Streel, M., Thorez, J., & Young, G. C. (2007). The biostratigraphical and palaeogeographical framework of the earliest diversification of tetrapods (Late Devonian). Geological Society, London, Special Publications, 278(1), 219‑235. https://doi.org/10.1144/SP278.10
Blom, H., Clack, J. A., Ahlberg, P. E., & Friedman, M. (2007). Devonian vertebrates from East Greenland : A review of faunal composition and distribution. Geodiversitas, 29(1), 119‑141.
Bray, A., & Lawson, J. D. (1985). The evolution of the terrestrial vertebrates : Environmental and physiological considerations. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 309(1138), 289‑322.
Campbell, K., & Bell, M. (1977). A primitive amphibian from the Late Devonian of New South Wales. Alcheringa, 1(4), 369‑381.
Carr, R. K., & Jackson, G. L. (2008). The vertebrate fauna of the Cleveland Member (Famennian) of the Ohio Shale. Guide to the Geology and Paleontology of the Cleveland Member of the Ohio Shale (68th Annual Meeting of the Society of Vertebrate Paleontology, Cleveland, Ohio.
Clack, J. A., Ahlberg, P. E., Blom, H., & Finney, S. M. (2012). A new genus of Devonian tetrapod from North-East Greenland, with new information on the lower jaw of Ichthyostega. Palaeontology, 55(1), 73‑86. https://doi.org/10.1111/j.1475-4983.2011.01117.x
Clack, J. A., Ahlberg, P. E., Finney, S., Dominguez Alonso, P., Robinson, J., & Ketcham, R. A. (2003). A uniquely specialized ear in a very early tetrapod. Nature, 425(6953), 65‑69.
Clément, G., Ahlberg, P. E., Blieck, A., Blom, H., Clack, J. A., Poty, E., Thorez, J., & Janvier, P. (2004). Devonian tetrapod from western Europe. Nature, 427(6973), 412‑413. https://doi.org/10.1038/427412a
Coates, M., & Clack, J. A. (1990). Polydactyly in the earliest known tetrapod limbs. Nature, 347(6288), 66‑69.
Crowson, R. A., Showers, W. J., Wright, E. K., & Hoering, T. C. (1991). Preparation of phosphate samples for oxygen isotope analysis. Analytical Chemistry, 63(20), 2397‑2400. https://doi.org/10.1021/ac00020a038
Daeschler, E. B., Shubin, N. H., Thomson, K. S., & Amaral, W. W. (1994). A Devonian Tetrapod from North America. Science, 265(5172), 639‑642. https://doi.org/10.1126/science.265.5172.639
Fourel, F., Martineau, F., Lécuyer, C., Kupka, H.-J., Lange, L., Ojeimi, C., & Seed, M. (2011). 18O/16O ratio measurements of inorganic and organic materials by elemental analysis–pyrolysis–isotope ratio mass spectrometry continuous-flow techniques. Rapid Communications in Mass Spectrometry, 25(19), 2691‑2696. https://doi.org/10.1002/rcm.5056
Fourel, F., Martineau, F., Seris, M., & Lécuyer, C. (2015). Measurement of 34S/32S Ratios of NBS 120c and BCR 32 Phosphorites Using Purge and Trap EA-IRMS Technology. Geostandards and Geoanalytical Research, 39(1), 47‑53. https://doi.org/10.1111/j.1751-908X.2014.00297.x
Godwin-Austen, R. (1855). On the possible extension of the coal-measures beneath the south-eastern part of England. Quarterly Journal of the Geological Society, 11(1‑2), 533‑536.
Goedert, J., Broussard, D., Trop, J., Daeschler, E., Amiot, R., Fourel, F., Olive, S., Vinçon-Laugier, A., & Lécuyer, C. (2024). Oxygen and sulfur stable isotope ratios of Late Devonian vertebrates trace the relative salinity of their aquatic environments. GSA Bulletin. https://doi.org/10.1130/B37631.1
Goedert, J., Fourel, F., Amiot, R., Simon, L., & Lécuyer, C. (2016). High-precision 34S/32S measurements in vertebrate bioapatites using purge-and-trap elemental analyser/isotope ratio mass spectrometry technology. Rapid Communications in Mass Spectrometry, 30(18), 2002‑2008. https://doi.org/10.1002/rcm.7690
Goedert, J., Lécuyer, C., Amiot, R., Arnaud-Godet, F., Wang, X., Cui, L., Cuny, G., Douay, G., Fourel, F., & Panczer, G. (2018). Euryhaline ecology of early tetrapods revealed by stable isotopes. Nature, 558(7708), 68‑72.
Laurin, M., & Soler-Gijón, R. (2010). Osmotic tolerance and habitat of early stegocephalians : Indirect evidence from parsimony, taphonomy, palaeobiogeography, physiology and morphology. Geological Society, London, Special Publications, 339(1), 151‑179.
Lebedev, O. (2004). A new tetrapod Jakubsonia livnensis from the Early Famennian (Devonian) of Russia and palaeoecological remarks on the Late Devonian tetrapod habitats. Acta Universitas Tatviensis, 679, 79‑98.
Lebedev, O. A., & Clack, J. A. (1993). Upper Devonian tetrapods from Andreyevka, Tula region, Russia. Upper Devonian tetrapods from Andreyevka, Tula region, Russia, 36(3), 721‑734.
Lécuyer, C., Fourel, F., Martineau, F., Amiot, R., Bernard, A., Daux, V., Escarguel, G., & Morrison, J. (2007). High-precision determination of 18O/16O ratios of silver phosphate by EA-pyrolysis-IRMS continuous flow technique. Journal of Mass Spectrometry, 42(1), 36‑41. https://doi.org/10.1002/jms.1130
Lécuyer, C., Grandjean, P., O’Neil, J. R., Cappetta, H., & Martineau, F. (1993). Thermal excursions in the ocean at the Cretaceous—Tertiary boundary (northern Morocco) : δ18O record of phosphatic fish debris. Palaeogeography, Palaeoclimatology, Palaeoecology, 105(3‑4), 235‑243.
Lu, C., Cui, X.-D., Chen, J., Cui, Z.-X., Zhu, M., & Xu, Y.-G. (2024). Devonian sea surface temperature and paleoecology changes constrained by in situ oxygen isotopes of fish fossils. Palaeogeography, Palaeoclimatology, Palaeoecology, 639, 112059. https://doi.org/10.1016/j.palaeo.2024.112059
Marshall, J. E. A., Astin, T. R., & Clack, J. A. (1999). East Greenland tetrapods are Devonian in age. Geology, 27(7), 637‑640. https://doi.org/10.1130/0091-7613(1999)027<0637:EGTADI>2.3.CO;2
Martin, J. E., Tacail, T., & Balter, V. (2017). Non-traditional isotope perspectives in vertebrate palaeobiology. Palaeontology, 60(4), 485‑502. https://doi.org/10.1111/pala.12300
McClay, Norton, M., Coney, P., & Davis, G. (1986). Collapse of the Caledonian orogen and the Old Red Sandstone. Nature, 323(6084), 147‑149.
McGhee Jr, G. R. (2006). Extinction : Late Devonian Mass Extinction. In eLS. John Wiley & Sons, Ltd. https://doi.org/10.1038/npg.els.0004177
Nehlich, O. (2015). The application of sulphur isotope analyses in archaeological research : A review. Earth-Science Reviews, 142, 1‑17. https://doi.org/10.1016/j.earscirev.2014.12.002
Niedźwiedzki, G., Szrek, P., Narkiewicz, K., Narkiewicz, M., & Ahlberg, P. E. (2010). Tetrapod trackways from the early Middle Devonian period of Poland. Nature, 463(7277), 43‑48.
Olsen, H., & Larsen, P. H. (1993). Lithostratigraphy of the continental Devonian sediments in North-East Greenland. Bulletin Grønlands Geologiske Undersøgelse, 165, 1‑108. https://doi.org/10.34194/bullggu.v165.6721
Pan, J., Huo, F., Cao, J., Gu, Q., Liu, S., Wang, J., Gao, L., & Liu, C. (1987). Continental Devonian System of Ningxia and its biotas. Beijing: Geol Publ House, 1‑237.
Pierce, S. E., Clack, J. A., & Hutchinson, J. R. (2012). Three-dimensional limb joint mobility in the early tetrapod Ichthyostega. Nature, 486(7404), 523‑526.
Säve-Söderbergh, G. (1932). Preliminary Note on Devonian Stegocephalians from East Greenland, &c.
Schmitz, B., ÅBERG, G., Werdelin, L., Forey, P., & Bendix-Almgreen, S. E. (1991). 87Sr/86Sr, Na, F, Sr, and La in skeletal fish debris as a measure of the paleosalinity of fossil-fish habitats. Geological Society of America Bulletin, 103(6), 786‑794.
Schultze, H.-P., & Cloutier, R. (1996). Comparison of the Escuminac Formation ichthyofauna with other late Givetian/early Frasnian ichthyofaunas. Devonian fishes and plants of Miguasha, Quebec, Canada, 348‑368.
Shubin, N. H., Daeschler, E. B., & Coates, M. I. (2004). The Early Evolution of the Tetrapod Humerus. Science, 304(5667), 90‑93. https://doi.org/10.1126/science.1094295
Trueman, C. N., & Tuross, N. (2002). Trace Elements in Recent and Fossil Bone Apatite. Reviews in Mineralogy and Geochemistry, 48(1), 489‑521. https://doi.org/10.2138/rmg.2002.48.13
Woodward, A. S. (1889). Catalogue of the Fossil Fishes in the British Museum (Natural History.) (Vol. 1). Taylor & Francis.
Zhu, M., Ahlberg, P. E., Zhao, W., & Jia, L. (2002). First Devonian tetrapod from Asia. Nature, 420(6917), 760‑761. https://doi.org/10.1038/420760a
Ont participé au travail d’écriture de cet article, en collaboration avec Jean Goedert, chercheur en paléontologie/géochimie (par ordre alphabétique) : AFONSO FERNANDES Beatriz, AIT ININOU DELCOURT Shayna, ALONSO Elena, AZAÏS Cameron, CHAOUI Nada, CHOCHOY-VANDECRUX Leo, COLAS Myla, CRIBIER Enola, CRISTOS Victoria, DE COMMINES DE MARSILLY Juliette, DUIZABO Léopold, DUPOUY Aïnhoa, FU Lucas, LACAN Pablo, LAFOURCADE Lohan, LAHOURCADE Zoé, LANGEVELD–ORRELL Tarquin, LASSALLE Naïcia, LATERRADE Martin, LE PAGE Mahina, LEVEAU Sacha, MARCADIEU Alice, POLONI Lizenn, RIBAUDO Enzo, VIGNOLA Chris, YRIARTE Amaya, ZEMOUR FORTUNA Meï-Lin
Comment citer cet article : Jean Goedert et la 3ème B du collège Aimé Césaire (St Geours de Marenne, FR), Le milieu de vie aquatique des premiers tétrapodes : une histoire de delta ?, Journal DECODER, 2024-06-28
